(1)下图是部分短周期元素原子半径与原子序数的关系图。
①由X、Y形成的既含离子键又含共价键的物质的电子式:
②实验室制备N单质的离子反应方程式:
(2)CaCO3是一种难溶物质,其Ksp=2.8×10-9。现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.8×10-5mol/L,则生成沉淀所需CaCl2溶液的最小浓度为 。
(3)羟胺(NH2OH) 可看成是氨分子内的l 个氢原子被羟基取代的产物,常用作还原剂,其水溶液显弱碱性。NH2OH 的水溶液呈弱碱性的原理与NH3的水溶液相似,用电离方程式表示NH2OH 在水溶液中显碱性的原因 。
(4)“甲醇-空气”绿色燃料电池的工作原理示意图
写出以石墨为电极的电池工作时负极的电极反应式 ,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH= (溶液电解前后体积的变化忽略不计)。
【化学——选修2:化学与技术】
海洋是一个丰富的资宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和 池。
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用: (写一点即可)。
(2)电渗析法是近年发展起的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
①海水不能直接通入到阴极室中,理由是 。
②A口排出的是 (填“淡水”或“浓水”)。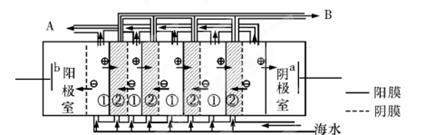
(3)用苦卤(含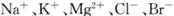 等离子)可提取溴,其生产流程如下:
等离子)可提取溴,其生产流程如下: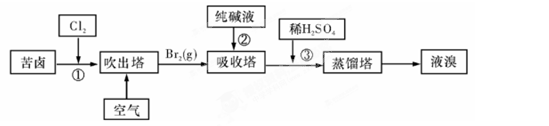
①若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为: 。
②通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化重新获得含Br2的溶液? 。
③向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是 。
H2O2在工业、农业、医药上都有广泛的用途。
(1)H2O2是二元弱酸,写出第一步的电离方程式 ,第二步的电离平衡常数表达式Ka2= 。
(2)许多物质都可以做H2O2分解的催化剂。一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化)。下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是 。
①I-②Fe3+③Cu2+④Fe2+
(3)用碱性氢氧燃料电池合成H2O2,具有效率高,无污染等特点。电池总反应为:
H2 + O2 + OH- = H2O + HO2-。写出正极反应式: 。
(4)H2O2是一种环境友好的强氧化剂。电镀废水(主要含Cu2+、Ni2+,还含少量Fe3+、Fe2+、Cr3+ 等)制备硫酸镍的一种流程如下:
①第(ⅰ)步,加入H2O2反应的离子方程式 。
②第(ⅱ)步,滤渣中的主要成分在医疗上的用途是 。
③为测定NiSO4·n H2O的组成,进行如下实验:称取2.627g样品,配制成250.00 mL溶液。准确量取配制的溶液25.00 mL,用0.04000 mol·L-1的EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++ H2Y2-=NiY2-+ 2H+),消耗EDTA标准溶液25.00 mL。则硫酸镍晶体的化学式为 。
【化学—物质结构与性质】氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。基态Ti原子的电子排布式是________。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2  2NH3,实现储氢和输氢。下列说法正确的是________________。
2NH3,实现储氢和输氢。下列说法正确的是________________。
| A.NH3分子中氮原子的轨道杂化方式为sp2杂化 |
| B.NH4+与PH4+、CH4、BH4-、ClO4-互为等电子体 |
| C.相同压强时,NH3的沸点比PH3的沸点高 |
| D.[Cu(NH3)4]2+中,N原子是配位原子 |
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是___________。
(4)N2H4中的N原子的杂化类型是__________;N与O第一电离能大小关系是:N___O。
(5)NiO的晶体结构与氯化钠相同,在晶胞中镍离子的配位数是_______。已知晶胞的边长为a nm,NiO的摩尔质量为b g·mol-1,NA为阿伏加德罗常数的值,则NiO晶体的密度为_________g·cm-3。
I.磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如下图: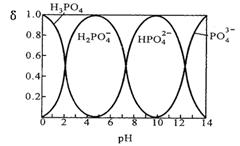
①从图中推断NaH2PO4溶液呈 性(填“酸”、“碱”或“中”),这说明 。
②在Na2HPO4溶液中,c(Na+)/c(HPO42—) 2(填“>”“=”“<”);向该溶液中滴入几滴浓NaOH溶液后,c(Na+)/ c(HPO42—)的值增大,原因是 。
③羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,有关反应为:
5Ca(OH)2+3H3PO4=Ca5(PO4)3OH+9H2O。下图是生产羟基磷灰石时得到的实验曲线,请计算磷酸的初始浓度为0.70mmol/L,pH=9.0条件下,反应前10min内磷酸的沉淀速率 。
II.在某温度下,把4.0mol NH3溶于水中配成1L溶液,测得溶液中OH-浓度和时间的图像如下: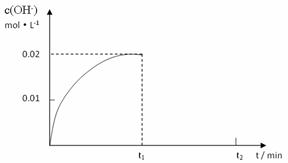
①求该温度时,氨水的电离平衡常数K(写出计算过程,结果保留三位有效数字)
②在t1时刻时再加入H2O配成2L溶液,在t2时刻时重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线。
③将a mol/L的盐酸和b mol/L氨水等体积混合,所得溶液呈中性(忽略混合前后溶液体积的变化),则混合后溶液中:c(NH3·H2O)= 。(用含有a、b的式子表示)
(14分)中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据计算PM2.5待测试样的pH =_____________ 。
(2)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下: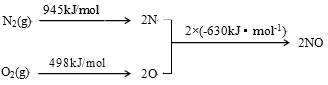
①N2(g)+O2(g)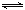 2NO(g) △H= 。
2NO(g) △H= 。
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式 。
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下: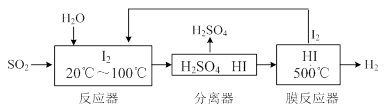
①用离子方程式表示反应器中发生的反应 。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是____________。
③检验产物中含有硫酸的方法是___________________。