铜是一种有色金属与人类关系非常密切。铜及其化合物在生产、生活中有广泛的应用。某同学对Cu的常见化合物的性质进行实验探究,研究的问题和过程如下:
(1)为探究不同价态铜的稳定性,进行如下实验:
向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为_________;由此可知,在酸性溶液中,+2价Cu比+1价Cu更 (填“稳定”或“不稳定”)。
(2)硫酸铜是一种应用广泛的化工原料,实验室中可通过不同途径制取硫酸铜溶液和胆矾(CuSO4·5H2O),其中一种流程如图:
①杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是________(填字母代号)。
a.该条件下铜无法被氧气氧化 b.灼烧不充分.铜未被完全氧化
c.氧化铜在加热过程中分解生成铜 d.灼烧过程中部分氧化铜被还原
②若将杂铜换为纯净的铜粉,可直接向其中加入稀硫酸和Fe2(SO4)3溶液,不断通入氧气。反应完全后向其中加入过量________(填化学式,下同),调节pH至 ,生成沉淀 ,过滤得硫酸铜溶液。已知:
| |
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
| Fe3+ |
2.7 |
3.7 |
| Fe2+ |
7.6 |
9.6 |
| Cu2+ |
4.7 |
6.7 |
(3)通过下述图1装置也可制取硫酸铜溶液(已知:2NaOH+2NO2=NaNO3+NaNO2+H2O)。
烧瓶内发生反应的化学方程式为__________________;
图2是图1的改进装置,
其优点有①____________________,②_________________ 。
(4)为测定CuSO4·5H2O晶体的纯度,进行下列实验:取a g试样配成l00 mL溶液,每次取20.00mL,消除干扰离子后,用b mol·L-1EDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液l2.00 mL。(常温时,5%的Na2H2Y水溶液,其pH为4—6。)
①CuSO4·5H2O晶体的纯度是 。
②下列滴定方式中,最合理的是(夹持部分略去) (填序号)。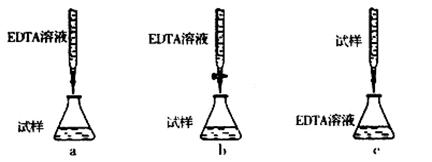
根据下列叙述,写出元素名称并画出原子结构示意图。
(1)A元素原子核外M层电子数是L层电子数的一半:_____________。
(2)B元素原子的最外层电子数是次外层电子数的1.5倍____________。
(3)C元素的次外层电子数是最外层电子数的1/4:__________________。
(4)D元素的单质在常温下可与水剧烈反应,产生的气体能使带火星木条复燃______。
画出下列各种粒子结构示意图。
(1)最外层电子数是次外层电子数4倍的正二价金属阳离子:_______。
(2)L层电子数是K层、M层电子数之和的原子:_______。
(3)质量数等于24,质子数等于中子数的原子:_______。
(4)得到1个电子能达到Ne原子结构的原子:_______。
在1911年前后,新西兰出生的物理学家——卢瑟福把一束变速运动的α粒子(质量数为4的带2个正电荷的质子粒),射向一片极薄的金箔,他惊奇地发现,过去一直认为原子是“实心球”,而由这种“实心球”紧密排列而成的金箔,竟让大多数α粒子畅通无阻地通过,就像金箔不在那儿似的,但也有极少量的α粒子发生偏转,或被笔直地弹回。根据以上叙述的实验现象能得出关于金箔中Au原子结构的一些结论,试写出其中的三点。
A.______________________________;
B.______________________________;
C.______________________________。
有A、B、C三种元素,其核电荷数之和为32,A为原子核内有12个中子的金属元素,形成化合物时显+2价,当2.4 g单质A与足量稀硫酸反应时,产生2.24 L H2(标准状况)。B有两个电子层,且各电子层的电子数与电子层总数相等。
(1)写出元素A、B、C的名称及元素符号:A_____,B_____,C_____。
(2)A2+、B、C2-的结构示意图分别是________,________,________。
下列粒子中:(其中P表示质子,n表示中子,e-表示电子)
| A.12P,12n,10e- | B.14P,14n,14e- |
| C.17P,18n,17e- | D.17P,20n,17e- |
E.17P,18n,18e- F.17P,20n,18e-
属于原子的是_____(填编号,下同);属于阳离子的是____;属于阴离子的是____;属于同一种元素的粒子是____。