中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是
| 选项 |
规律 |
结论 |
| A |
较强酸可以制取较弱酸 |
用亚硫酸溶液无法制取硫酸溶液 |
| B |
升高温度,反应速率越快 |
常温下钠与氧气反应生成氧化钠,升高温度,Na2O的生成速率加快 |
| C |
金属越活泼,其阳离子氧化性越弱 |
Fe3+的氧化性弱于Cu2+ |
| D |
Ksp小的沉淀易向Ksp更小的沉淀转化 |
CaSO4悬浊液中滴加Na2CO3溶液可生成CaCO3沉淀 |
在容积不变的密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g)△H<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中正确的是
2SO3(g)△H<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中正确的是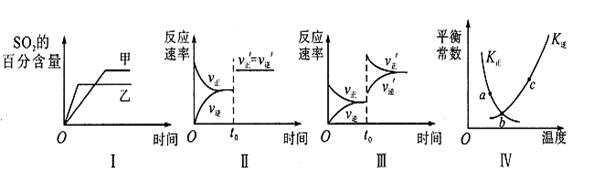
| A.图I表示温度对化学平衡的影响,且甲的温度较高 |
| B.图Ⅱ表示t0时刻使用催化剂对反应速率的影响 |
| C.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响 |
| D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态 |
一定条件下,有关金属腐蚀的下列说法不正确的是
| A.为减缓金属腐蚀,可将要保护的金属物件与外电源的正极相连接做阴极 |
| B.在pH<5的溶液中,金属主要发生析氢腐蚀 |
| C.钢铁制品吸氧腐蚀时正极反应为:O2+2H2O+4e-=4OH- |
| D.在金属物件表面涂上机油可防止金属生锈从而使金属保持光泽 |
反应A(s)+2B(g) 2C(g)在一密闭容器中进行,当改变下列条件之一时,一定能增大反应速率的是
2C(g)在一密闭容器中进行,当改变下列条件之一时,一定能增大反应速率的是
| A.增加A物质的质量 | B.降低温度 |
| C.压缩反应容器体积 | D.消耗掉部分B物质 |
有机物R结构如图所示
下列说法正确的是
| A.R分子中有7种化学环境均不同的氢原子 |
| B.R和溴水反应后所得产物的化学式为C11H12O3Br2 |
| C.R在碱性条件下的水解产物均难溶于水 |
| D.R不能使酸性高锰酸钾溶液褪色 |
铅蓄电池的示意图如图所示。下列说法正确的是
| A.放电时,N为负极,其电极反应式为: PbO2+SO42-+4H++2e-=PbSO4+2H2O |
| B.放电时,c(H2SO4)不变,两极的质量增加 |
| C.充电时,阳极反应式为:PbSO4+2e-= Pb+SO42- |
| D.充电时,若N连电源正极,则该极生成PbO2 |