CO的应用和治理问题属于当今社会的热点问题。
(1)HCOOH的酸性略强于醋酸,是实验室制取CO的主要试剂,在0.1mol/L HCOOH溶液中,溶质分子和各种离子浓度由大到小的顺序为 。
(2)为防止镍系催化剂中毒,工业上常用SO2除去原料气中少量CO,生成物为固体S和CO2。
该反应的热化学方程式为 。
(已知:硫的燃烧热为296 kJ·mol-1;一氧化碳燃烧热为283 kJ·mol-1)
(3)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g) 
 COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题: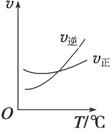

①0~6 min内,反应的平均速率v(Cl2)= ;
②若保持温度不变,在第8 min 加入体系中的三种物质各1 mol,则平衡 移动(填“向 正反应方向”、“向逆反应方向”或“不”);
③若将初始投料浓度变为c(Cl2)=0.8 mol/L、c(CO)=0.6 mol/L、c(COCl2)= mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同;
④随温度升高,该反应平衡常数变化的趋势是 ;(填“增大”、“减小”或“不变”)
④比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8)________T(15) (填“<”、“>”或“=”)。
(4分)下列叙述正确的是________________(选对一个给2分,多选、错选一个扣1分,本题不出现负分)。
| A.不慎把苯酚溶液沾到了皮肤上,应立即用大量水冲洗。 |
| B.甲、乙两种有机物具有相同的相对分子质量和不同结构,则甲和乙一定是同分异构体。 |
| C.浓溴水滴入苯酚溶液中立即产生2,4,6-三溴苯酚的白色沉淀。 |
| D.溴的苯溶液中加少量铁粉后会剧烈反应,并放出大量的热,但该现象不能说明苯和溴的取代反应就是放热反应。 |
E.分离沸点相差30℃以上的混溶液体,应采用的方法是分馏
F.实验室使用体积比为1:3的浓硫酸与乙醇的混合溶液制乙烯时,为防加热时反应混合液出现暴沸现象,除了要加沸石外,还应注意缓慢加热让温度慢慢升至170℃。
G.除去混在苯中的少量苯酚,加入过量溴水,过滤。
 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
(1)A与银氨溶液反应有银镜生成,则A的结构简式是。
(2)B→C的反应类型是。
(3)E的结构简式是。
(4)写出F和过量NaOH溶液共热时反应的化学方程式:
。
(5)下列关于G的说法正确的是。
a.能与溴单质反应 b.能与金属钠反应
c.1molG最多能和3mol氢气反应 d.分子式是C9H6O3
(18分)下图中A、B、C、D、E、F、G均为有机化合物。
根据上图回答问题:
(1)D的化学名称是__________。
(2)反应③的化学方程式是__________。(有机物须用结构简式表示)
(3)B的分子中官能团的名称___________________。A的结构简式是 ___________________。反应①的反应类型是__________。
(4)符合下列3个条件的B的同分异构体的数目有__________个。
①含有邻二取代苯环结构;②与B有相同官能团;③不与FeCl3溶液发生显色反应写出其中任意一个同分异构体的结构简式____________________。
(5)已知:
请设计合理方案从
(用反应流程图表示,并注明反应条件)。
例:由乙醇合成聚乙烯的反应流程图可表示为:
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH= —196.6 kJ·mol-1
2SO3(g) ΔH= —196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH= —113.0 kJ·mol-1
2NO2(g) ΔH= —113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=kJ·mol-1
SO3(g)+NO(g)的ΔH=kJ·mol-1
一定条件下,将1 mol NO2与2 mol SO2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2物质的量之比为1:6,则平衡常数K=。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是。
(12分)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________________。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是______________。
(3)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是___________。
(4)当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为____________。反应所需时间的长短关系是__________。
(5)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是____________________________________________________________________。