pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加_________mL;
(2)如果加入pH=10的NaOH溶液,应加_________mL;
(3)如果加0.01mol/L HCl,应加_________mL。
氯气是重要的化工原料。
(1)氯气溶于水得到氯水,氯水中存在下列反应:Cl2 + H2O H++Cl-+ HClO,其平衡常数表达式为K= 。
H++Cl-+ HClO,其平衡常数表达式为K= 。
(2)工业上常用熟石灰和氯气反应制取漂白粉,化学反应方程式是。流程如下图所示,其主要设备是氯化塔,塔从上到下分四层。
将含有3%~6%水分的熟石灰从塔顶喷洒而入,氯气从塔的最底层通入。这样加料的目的是。处理从氯化塔中逸出气体的方法是。
(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是,其原因可能是,由此可知(2)中氯化塔设计为四层是为了减少生产中类似副反应的发生。
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
(1)溴在周期表中位于________周期__________族。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是___________________________。
(3)步骤④利用了SO2的还原性,反应的离子方程式为__________________________。
(4)步骤⑥的蒸馏过程中,温度应控制在80~90℃温度过高或过低都不利于生产,请解释原因____________________________________________________。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是______________________________________。
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氧化”后再蒸馏,这样操作的意义是_______________________。
胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料,现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
pH值控制可参考下列数据
| 物质 |
开始沉淀时的pH值 |
完全沉淀时的pH值 |
| 氢氧化铁 |
2.7 |
3.7 |
| 氢氧化亚铁 |
7.6 |
9.6 |
| 氢氧化铜 |
5.2 |
6.4 |
请根据上述流程回答下列问题:
(1)A可选用________(填字母)
a.稀H2SO4 b.浓H2SO4、加热 c.浓FeCl3溶液 d.浓HNO3
(2)Ⅰ中加H2O2的目的___________________________________________________。
(3)Ⅱ中加Cu2(OH)2CO3的目的是___________________________________,
其优点是_____________________________________________________________。
(4)Ⅲ加热煮沸时发生的化学反应的离子方程式为___________________________。
(5)V中加H2SO4调节pH=1是为了_________________________________________,
某工程师认为上述流程中所加的A物质并不理想,需作改进,其理由是______________,
若你是工程师,将对所加的A物质作何改进?请提出建议______________________。
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题:
(1)天然水中溶解的气体主要有、(填化学式)。
(2)检验蒸馏水的纯度时,最简单易行的方法是测定水的。
(3)水的净化与软化的区别是:水的净化是用混凝剂(如明矾等)使_,而水的软化是________。
(4)通过施加一定压力使水分子透过半透膜而将大分子或离子截留,从而使水得以净化的方法称为;电渗析法净化水时,使离子通过半透膜的推动力是。
(5)某天然水中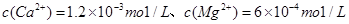 、
、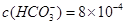
 。要软化10 m3这种天然水,需先加入Ca(OH)2 g,再加入Na2CO3g。
。要软化10 m3这种天然水,需先加入Ca(OH)2 g,再加入Na2CO3g。
请回答下列问题:
(1)分别用浓、稀硝酸溶解等量的两份铜粉,消耗硝酸的物质的量较少的是____硝酸(填“浓”或“稀”),相应的离子方程式是。
(2) 800℃时,在2 L的恒容密闭容器中充入2 mol NO和1mol O2发生反应,2NO(g)+O2(g) 2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。
2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。
①5 min内 v(O2)=。
②该条件下,2NO(g)+O2(g) 2NO2(g)的△H=。
2NO2(g)的△H=。
③若向平衡混合物中再充入NO、NO21mol,此时v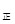 v
v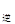 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
④若向平衡混合物中仅充入1mol NO2,平衡向____(填“正向”、“逆向”或“不”)移动。达新平衡时,NO2的体积分数____(填“增大”、“减小”或“不变”)。
(3)染料工业排放的废水中含有大量有毒的NO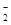 ,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____。
,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____。