下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向某溶液中先滴加氯水,再滴加少量KSCN溶液。 |
溶液变成血红色 |
溶液中含有Fe2+ |
| B |
向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/LFeCl3溶液 |
白色沉淀转化为红褐色沉淀 |
证明在相同温度下的Ksp: Mg(OH)2>Fe(OH)3 |
| C |
常温下,向浓硫酸中投入铁片 |
铁片不溶解 |
常温下,铁不与浓硫酸反应 |
| D |
向盛有碘水的试管中加入CCl4后充分振荡静置 |
液体分层,上层基本无色,下层紫红色 |
碘在CCl4中的溶解度较大 |
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(下图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。

甲乙
下列有关叙述正确的的是
| A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a |
| B.电极b是正极,O2-由电极a流向电极b |
| C.电极a的反应式为:CH4+4O2—―8e-=CO2 +2H2O |
| D.当固体电解质中有1 mol O2-通过时,电子转移4 mol |
T ℃时,在1 L的密闭容器中充入2 mol CO2和6 mol H2,一定条件下发生反应:
CO2(g)+3H2(g) 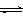 CH3OH(g)+H2O(g)△H=-49.0 kJ·mol-1
CH3OH(g)+H2O(g)△H=-49.0 kJ·mol-1
测得H2和CH3OH(g)的浓度随时间变化如下图所示。下列说法不正确的是
| 时间 |
c(H2)/mol·L-1 |
c(CH3OH)/mol·L-1 |
v(正)和v(逆) 比较 |
| t0 |
6 |
0 |
? |
| t1 |
3 |
1 |
v(正)=v(逆) |
| A.t0~t1时间内υ(H2)=3 /(t1 - t0) mol·(L·min)-1 |
| B.t1时,若升高温度或再充入CO2气体,都可以提高H2的转化率 |
| C.t0时,v(正)>v(逆) |
| D.T ℃时,平衡常数K = 1/27,CO2与H2的转化率相等 |
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是

下列实验操作或装置符合实验目的是
| 目的 |
用酸性KMnO4溶液滴定Na2SO3 |
配制稀硫酸溶液 |
在铁制品上镀铜 |
检查装置气密性 |
| 装置 或 操作 |
 |
 |
 |
 (关闭止水夹) (关闭止水夹) |
| 选项 |
A |
B |
C |
D |
2011年3月11日,日本本州岛仙台港发生9.0级地震,地震引发海啸,食盐、蔗糖、醋酸、“84消毒液”、明矾等是灾后居民日常生活中经常使用的物质,下列有关说法或表示正确的是
A.食盐中阴离子的结构示意图为: |
| B.蔗糖和醋酸都是弱电解质 |
C.“84消毒液”中有效成分NaClO的电子式为: |
| D.1 L 2 mol·L-1的明矾溶液完全水解制得的胶体中胶粒数等于2NA |