苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置
以苯甲酸、甲醇为原料制取苯甲酸甲酯。有关物质的物理性质见下表所示:
| |
苯甲酸 |
甲醇 |
苯甲酸甲酯 |
| 熔点/℃ |
122.4 |
-97 |
-12.3 |
| 沸点/℃ |
249 |
64.3 |
199.6 |
| 密度/g.cm-3 |
1.2659 |
0.792 |
1.0888 |
| 水溶性 |
微溶 |
互溶 |
不溶 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入0.1mol苯甲酸和0.4mol 甲醇,再小心加入 3mL浓硫酸,混匀后,投入几粒沸石,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)甲装置的作用是: ;冷却水从 (填“a”或“b”)口进入。
(2)化学小组在实验中用过量的反应物甲醇,其理由是 。
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制
(1)试剂1可以是 (填编号),作用是 。
A.稀硫酸 B.碳酸钠溶液 C.乙醇
(2)操作2中,收集产品时,控制的温度应在 ℃左右。
(3)实验制得的苯甲酸甲酯精品质量为10g,则苯甲酸的转化率为 (结果保留三位有效数字)。
(4)本实验制得的苯甲酸甲酯的产量低于理论产量,可能的原因是 (填编号)。
A.蒸馏时从100℃开始收集产品
B.甲醇用量多了
C.制备粗品时苯甲酸被蒸出
(12分)某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式_________________。
(2)甲和乙两个水浴作用不相同,乙的作用是___________________。集气瓶中收集到的气体的主要成分是_____________________。
(3)若试管a中收集到的液体用紫色石蕊试纸,试纸显红色,说明液体中还有____________。要除去该物质,可先在混合液中加入_________(填写字母)。
| A.氯化钠溶液 | B.苯 | C.碳酸氢钠溶液 | D.四氯化碳 |
然后再通过___________(填实验操作名称)即可除去。
(4)实验一段时间后,将试管a中的液体取出,加入足量的银氨溶液,再放入甲烧杯中,很快出现明显的现象。写出该反应的化学方程式: ;反应类型为
某兴趣小组同学进行乙醛的银镜反应,实验操作步骤如下:
| A.在试管里先注入少量NaOH溶液,振荡,然后加热煮沸。把NaOH溶液倒去后,再用蒸馏水洗净试管备用。 | B.在洗净的试管里配制银氨溶液。 | C.沿试管壁加入乙醛稀溶液。 | D.加热。请回答下列问题: |
(1)步骤A中加NaOH溶液振荡,加热煮沸的目的是: 。
(2)步骤D应选择的加热方法是(填下列装置编号)
(3)乙醛发生银镜反应的化学方程式为: 。
(4)该兴趣小组的同学还对乙醛进行银镜反应的最佳实验条件进行了探究(部分实验数据如下表):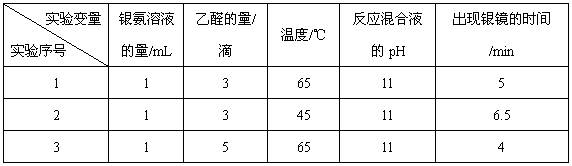
①实验1和实验2,探究的是。
②当银氨溶液的量为1 mL,乙醛的量为3滴,温度为55℃,反应混合液pH为11时,出现银镜的时间为min。(填范围)
③你认为探究乙醛进行银镜反应的最佳条件,除了测定银镜出现的时间外,还需要比较不同条件下形成的银镜的。
某小组同学利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,倒入大试管中迅速振荡混合均匀,再加入硫酸,开始计时,通过测定混合溶液褪色所需时间来判断反应的快慢(已知反应方程式为:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O)。该小组设计了如下方案。
| 编号 |
H2C2O4溶液 |
KMnO4溶液 |
硫酸溶液 |
温度/℃ |
||
| 浓度 (mol/L) |
体积 (mL) |
浓度 (mol/L) |
体积 (mL) |
|||
| ① |
0.10 |
2.0 |
0.010 |
4.0 |
4mL 4mol/L |
25 |
| ② |
0.20 |
2.0 |
0.010 |
4.0 |
4mL 4mol/L |
25 |
| ③ |
0.20 |
2.0 |
0.010 |
4.0 |
4mL 4mol/L |
50 |
(1)探究温度对化学反应速率影响的组合实验编号是__________(填编号,下同);探究反应物浓度对化学反应速率影响的组合实验编号是__________。
(2)该小组同学由此实验发现反应进行一些时间后,有一时间段反应速率不断加快。同学们分析除了反应放热使体系温度升高外,可能还有其它原因,他们联想到教材上的科学探究实验,推断出反应混合溶液中的__________(填化学式)也加速了此反应的进行。
(3)上述实验①中充分反应后H2C2O4过量,假设理论上能通过用酸性KMnO4溶液滴定的方法来测定反应混合液中过量的H2C2O4,请回答下列问题:
①取用反应混合液的滴定管用__________滴定管(填“酸式”或“碱式”,下同),盛装KMnO4溶液的滴定管用__________滴定管。
②下列操作中可能使测出的H2C2O4剩余量比理论值偏低的是__________。
A.读取酸性KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
B.滴定前盛放反应混合液的锥形瓶用蒸馏水洗净但没有干燥
C.盛装KMnO4溶液的滴定管滴定前有气泡,滴定后气泡消失
D.盛装KMnO4溶液的滴定管未润洗就直接注入酸性KMnO4溶液
③此滴定实验是否需要滴加指示剂________(填“是”或“否”);怎么确定此滴定的终点:_________。
根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场。因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题。目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:
2NO+2CO 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表(表中不要留空格)。
| 实验编号 |
实验目的 |
T/℃ |
NO初始浓度 mol/L |
CO初始浓度 mol/L |
同种催化剂的比表面积 m2/g |
| Ⅰ |
为以下实验作参照 |
280 |
6.50×10-3 |
4.00×10-3 |
80 |
| Ⅱ |
120 |
||||
| Ⅲ |
探究温度对尾气转化速率的影响 |
360 |
80 |
【图像分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下: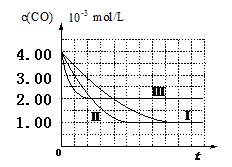
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为__________________;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率_____________
(填“增大”、“减小”、“无影响”);
(原创)硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1。
已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)步骤1:打开K1、关闭K2,向圆底烧瓶中加入足量甲并加热,则试剂甲为:
。
(2)步骤2:始终保持C中溶液呈碱性,反应一段时间后,硫粉的量逐渐减少,打开K2、关闭K1并停止加热。
①C中溶液须保持呈碱性的原因:若呈酸性,则 、
。(用离子方程式表示)
②装置B、D的作用是。
步骤3:将C中所得混合物分离提纯后得产品。
(3)利用反应2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2也能制备Na2S2O3。所需仪器如图2,按气流方向连接各仪器,接口顺序为:→g,h→,→,→d。
(4)装置乙盛装的试剂是:_____________________________。
(5)Na2S2O3还原性较强,工业上常用作除去溶液中残留的Cl2,该反应的离子方程
式为: 。
(6)请设计简单的实验方案,证明上述残留的Cl2被还原成了Cl—:____________
。