【化学——选修3:物质结构与性质】(15分)
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
①某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了 ,B元素位于周期表五个区域中的 区。
②ACl2分子中A的杂化类型为 ,ACl2的空间构型为 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 。
②六氰合亚铁离子[Fe(CN)6]4—中不存在 。
A.共价键
B.非极性键
C.配位键
D.σ键
E.π键
③写出一种与 CN—互为等电子体的单质分子式 。
(3)一种Al-Fe合金的立体晶胞如下图所示。请据此回答下列问题:
①确定该合金的化学式 。
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为 cm。
食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质。已知:
请回答下列问题:
(1)定温度下,向0.1 mol CH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是____(填代号)。
CH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是____(填代号)。
a.溶液的pH增大b.CH3COOH的电离程度增大
c.溶液的导电能力减弱d.溶液中c(OH- ).c(H+)不变
(2)25℃时,0.10 mol Na2CO3溶液的pH=11,则溶液中由水电离出的c(OH-):_____mol
Na2CO3溶液的pH=11,则溶液中由水电离出的c(OH-):_____mol  。
。
(3)常温下,将20 mL 0.10 mol  CH3COOH溶液和20 mL 0.10 mol
CH3COOH溶液和20 mL 0.10 mol HNO2溶液分别与20 mL 0.10 mol
HNO2溶液分别与20 mL 0.10 mol NaHCO3溶液混合(混合后溶液体积变化忽略不计)。
NaHCO3溶液混合(混合后溶液体积变化忽略不计)。
①反应开始时,v(CH3COOH)_________v(HNO2)(填“>”、“<”或“:”),原因是_________.
②充分反应后.两溶液中c(CH3COO-)_________c(NO2-)(填“>”、“<”或“=”)。
(4)25 C时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中
C时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中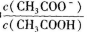 =__________。
=__________。
铜及其化合物在工农业生产及日常生活中应用非常广泛。某研究小组用粗铜(含杂质铁)制备氯化铜晶体(CuCl2.2H2O)的流程如下。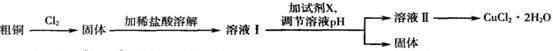
已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
请回答下列问题:
(1)溶液I中加入试剂X可以调节溶液pH,从而除去Fe3+且不引入杂质。
①试剂X可选用下列物质中的__________(填代号)。
a.CuOb.NaOHc.Cud.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是__________。
(2)由溶液Ⅱ制备CuCl2.2H2O的操作依次为:边滴加浓盐酸边加热浓缩、__________(填操作名称)、过滤、洗涤干燥。
(3)向溶液Ⅱ中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因:__________.
(4)某学习小组用碘量法测定CuCl2.2H2O样品的纯度(杂质不与发生反应)。实验如下:
a.准确称取CuCl2.2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250 mL待测溶液。(已知: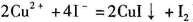 )
)
b.移取25. 00 mL待测溶液于锥形瓶中,加几滴指示剂,用c mol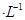 Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V mL。 (已知:
Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V mL。 (已知: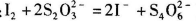 )
)
①实验中使用的指示剂名称为____________。
②达到滴定终点时,仰视滴定管读数将使测定结果_________(填“偏高”、“偏低”或“无影响”)。
③该样品中CuCl2.2H2O 的质量分数为_________(用含m、c、V的代数式表示,不用化简)。
利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g) WI2(g) △H<0
WI2(g) △H<0
(1)该反应的平衡常数表达式K=_________。
(2)在恒温恒容条件下,能够说明上述反应一定达到平衡状态的是_________(填代号)。
a.I2(g)与WI2(g)的浓度相等
b.W的质量不再变化
c.容器内混合气体的密度保持不变
d.容器内混合气体的压强保持不变
(3)在一定温度下,若平衡常数K=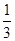 ,向2L恒容密闭容器中加入l mol I2(g)和足量W(s),5 min后反应达到平衡。则0-5 min内的平均反应速率v(WI2)=_________,平衡时I2(g)的转化率为_________。相同温度下,若开始加入I2(g)的物质的量是原来的2倍,则下列数值是原来的2倍的是____(填代号)。
,向2L恒容密闭容器中加入l mol I2(g)和足量W(s),5 min后反应达到平衡。则0-5 min内的平均反应速率v(WI2)=_________,平衡时I2(g)的转化率为_________。相同温度下,若开始加入I2(g)的物质的量是原来的2倍,则下列数值是原来的2倍的是____(填代号)。
a.平衡常数b.达到平衡的时间
c.I2的物质的量浓度d.平衡时WI2的体积分数
(4)为提高该反应的反应速率,同时使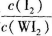 增大,可采取的措施为 ____________.
增大,可采取的措施为 ____________.
(5)工业上利用上述反应原理提纯金属钨的示意图如下: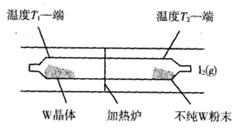
反应在石英真空管中进行,先在温度为T2的一端放入未提纯的W粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的晶体,则温度T1_________T2(填“>”‘<”或“=”)。上述反应体系中循环使用的物质是_________.
准确称取6g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL 稀H2SO4溶液的烧杯中,充分反应后过滤去掉沉淀A,向滤液中加入10mol/L的KOH溶液,产生沉淀的质量和加入的KOH溶液的体积(mL)如右图所示。试回答下列问题: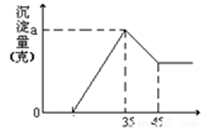
(1)沉淀A是(填化学式),当加入KOH溶液的体积超过35mL时所发生的反应的离子方程式为(4分)
(2)铝土矿中Al2O3的物质的量是多少?(2分)
(3)稀硫酸溶液的物质的量浓度为多少?(忽略溶液体积的变化)(2分)
如图所示:丁可能是强酸也可能是强碱。
(1)若丙是潜艇的供氧剂,请写出甲与水反应的离子方程式;若等物质的量的甲,乙,丙,丁的固体投入到足量且等量的水中完全反应所得溶液的质量分数由大到小的顺序是(用化学式表示)。
(2)若乙是能使品红溶液褪色的气体,请写出乙→丙的化学反应方程式;请写出乙可使氯水褪色的离子方程式__________________________.
(3)若甲可作为制冷剂,请写出甲→乙的化学反应方程式;将等量的铜粉分别与过量浓的丁溶液、稀的丁溶液反应,消耗丁的物质的量:前者后者,反应中转移的电子总数:前者后者(填“>”、“=”或“<”)