现有室温下的四种溶液,其pH如下表所示,下列有关叙述不正确的是
| |
① |
② |
③ |
④ |
| pH |
11 |
11 |
3 |
3 |
| 溶液 |
氨水 |
NaOH溶液 |
醋酸 |
盐酸 |
A.③④中分别加入适量醋酸钠晶体,两溶液pH均增大
B.②③两溶液等体积混合,所得溶液中:c(H+)>c(OH-)
C.分别加水稀释10倍,溶液的pH:①>②>④>③
D.V1L④和V2L①溶液混合后,若pH=7,则V1<V2
准确量取25.00mLKMnO4溶液,可选用的仪器是:
| A.50mL量筒 | B.10mL量筒 |
| C.50mL酸式滴定管 | D.50mL碱式滴定管 |
25℃时,下列溶液中微粒存在情况合理的是
| A.Fe2+、Mg2+、ClO-、Cl-能大量共存 |
| B.含Br-、K+、Na+、HSO3-的溶液,通入SO2后这些离子仍能大量共存 |
C.含K+、Na+、NO3-、CH3COO-的溶液中c(H+)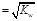 |
| D.硝酸钠和碘化钡混合溶液中,溶质离子浓度为c(Ba2+)=0.2mol·L-1,c(Na+)=0.2mol·L-1,c(NO3-)=0.3mol·L-1,c(I-)=0.1mol·L-1 |
根据下图,下列判断中正确的是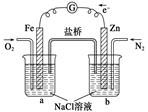
| A.烧杯a中的溶液pH升高 |
| B.烧杯a中发生的反应为2H2O+2e-=H2↑+2OH- |
| C.烧杯b中发生还原反应 |
| D.烧杯b中发生的反应为2Cl--2e-=Cl2↑ |
下列热化学方程式书写正确的是(ΔH的绝对值均正确)
A.C(s)+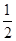 O2(g)=CO(g) ΔH=-110.5kJ·mol-1 (燃烧热) O2(g)=CO(g) ΔH=-110.5kJ·mol-1 (燃烧热) |
| B.2H2O(g)=2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1(反应热) |
| C.C2H5OH+3O2=2CO2+3H2O ΔH=-1368.8 kJ·mol-1(反应热) |
| D.2NaOH(aq)+H2SO4(aq)=Na2SO4 (aq)+2H2O(l) ΔH=-114.6 kJ·mol-1(中和热) |
下列不属于农药污染综合治理措施的是
| A.研制低毒、低残留农药 | B.改进农药使用方法,控制一次使用量 |
| C.禁止在农田中使用农药 | D.综合防治植物病虫,减少农药用量 |