常温下,氯化钠的溶解度为36克,某同学欲配制50g溶质质量分数为10%的NaCl溶液,操作流程如图:
(1)该同学应称取氯化钠的质量是 g,量取水的体积为 mL(水的密度可近似为1g/cm3);
(2)图中的一处错误是: ;
(3)称取食盐时,如发现指针偏向分度盘右侧,说明托盘上药品的质量 应称量的质量(填:“>”或“<”);
(4)如果最后配得的氯化钠溶液的溶质质量分数小于10%,则造成此误差的可能原因有 (填序号)。
| A.称量前天平没有调平 |
| B.砝码上有油污 |
| C.称量纸上残留少量食盐 |
| D.向烧杯中加水时,有少量水溅出烧杯外 |
E.右盘上没有放称量纸
(5)常温下氯化钠饱和溶液中溶质的质量分数为 ,欲使上述配得的溶液成为饱和溶液可向其中补
加 克氯化钠。
化学和人类的生存与发展密切相关。
|
(1)下列各种食物中,富含蛋白质的是 。


化学与人类进步和社会发展有着密切的关系。
(1)我们常用洗涤剂清洗餐具上的油污 ,这是因为洗涤剂具有的功能。
(2)米饭等主食中富含的营养物质是。快餐米饭常用一次性发泡餐盒盛装,此泡沫餐盒主要材质是聚苯乙烯,本身无毒无害,聚苯乙烯塑料属于材料。
(3)改良土壤有利于农作物生长。化学兴趣小组的同学们测定出某块农田的土壤
pH<7,则土壤呈性,要改良此土壤应该施加适量的。
(4)科学家们不断研发新能源。“神舟九号”飞船的运载火箭所用的高能燃料是偏二甲(化学式为C2H8N2),在点燃的条件下,它与N2O4反应生成氮气、水和二氧化碳。该反应的 化学方程式为。
甲、乙、丙三种物质有如右图所示的转化关系。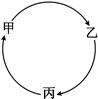
Ⅰ.若甲、乙、丙依次是氢气、水、硫酸。
(1)写出丙→甲的化学方程式: ___ ___。
(2)乙→丙时所需另一种反应物中,一定含有氧元素和___ _元素。
Ⅱ.若甲为氢氧化钠,丙为硫酸钠。
(3)乙可以是___ _____。
Ⅲ.已知难溶性的碱受热会分解生成相应的金属氧化物和水。若甲是氧化铜,乙的水溶液呈蓝色,丙属于碱类。
(4)甲→乙还需要的试剂可以是________。
(5)写出乙→丙的化学方程式:________,属于反应。
化学与生活密切相关,人们的衣食住行蕴含着丰富的化学知识,掌握了这些知识有助于我们更安全、健康、快乐地生活。


(1)5月20日是“中国学生营养日”。某校食堂午餐的食谱是:米饭、清蒸鱼、醋溜排骨、鱼丸汤,其中能为学生提供富含糖类的食物是。考虑到学生身体发育对各种营养素的均衡需要,食堂再补充了一种富含的食物。
(2)下列主要由无机非金属材料制成的是(填序号);
| A.涤纶制成的航天服 | B.陶罐 | C.玻璃酒杯 | D.塑料桶 |
(3)出行使用电动自行车,利于减少环境污染。电动自行车行驶时电池将能转化为电能。
(4)过氧化钙的化学式为CaO2,国家禁止过氧化钙做面粉添加剂,但可作鱼池增氧剂,它与水反应的化学方程式为:2CaO2 + 2H2O =" 2X" + O2↑;其中X用途广泛,请写出X的化学式,并说出关于X的一项用途:。
(5)媒体报道某市高层住宅发生火灾,原因是电焊工违章操作产生电火花,引燃了事故现场使用的大量尼龙网、聚氨酯泡沫塑料等易燃材料。就此事件回答下列问题:
①溅落的电火花在这场火灾中所起的作用是___________(填序号)。
A 提供氧气 B 使温度达到可燃物的着火点 C 提供可燃物
②聚氨酯泡沫塑料燃料产生的烟气中,含有多种对人体有害的气体,写出其中一种能与血红蛋白的有毒气体的化学式______________。
③废弃的聚氨酯泡沫塑料会给环境带来。
我国家用能源的发展已经进入到了燃气时代。小华在家里打开煤
气罐(内装液体燃料)时,听到“咝咝”的声音。请用分子的观点解释这一现象:。如果你是小华,在家里你检测燃气是否泄漏的简单方法是为了便于提醒用户煤气是否泄漏,国家统一规定必须在燃气中加入乙硫醇(化学式为C2H6S)。请说出乙硫醇可能具有的性质(至少两条)。
(2)刘菲为同学们表演了一组魔术,她在3个盛有相同液体的玻璃杯(分别编号A、B、C)中,分别倒入三种不同的液体,同学们看到下列奇特现象:A杯变成红葡萄酒,B杯变成“汽水”(有大量气体生成),C杯变成“牛奶”(有白色浑浊)。请你给刘菲揭开魔术的秘密。
①B杯中生成的气体可能是(填化学式)。
②写出C杯中可能发生反应的化学方程式:。