将112mLCl2(标准状况)通入10mL1mol/L的FeBr2溶液中(还原性:Fe2+大于Br-),发生反应的离子方程式是
| A.Cl2+2Br-=2Cl-+Br2 | B.2Fe2++Cl2=2Fe3++2Cl- |
| C.2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 | D.2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 |
被严重腐蚀了的铜和铁共同放入盐酸中充分反应后,剩余残渣中只有铜,则溶液中含有的金属阳离子为( )
| A.可能只含Fe2+ |
| B.可能只含Cu2+ |
| C.一定含有Fe2+和Cu2+ |
| D.可能只含Cu2+和Fe3+ |
用质量均为100 g的铜棒作电极,电解硝酸银溶液,电解一段时间后,两个电极的质量差为28 g,则阴极的质量为( )
| A.128 g | B.114 g |
| C.119 g | D.121.6 g |
某溶液中有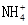 、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是(双选)( )
、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是(双选)( )
A.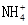 |
B.Mg2+ |
| C.Fe2+ | D.Al3+ |
铝制品比铁制品在空气中不易被锈蚀,原因是( )
| A.铝的金属活动性比铁弱 |
| B.铝的密度比铁的密度小 |
| C.铝在空气中易与氧气形成一层致密的氧化膜 |
| D.铝不能跟氧气发生化学反应 |
下列反应的方程式正确的是( )
| A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体: Fe3++3H2O  Fe(OH)3↓+3H+ Fe(OH)3↓+3H+ |
| B.用氢氟酸蚀刻玻璃:4HF+SiO2===SiF4↑+2H2O |
| C.用浓盐酸与MnO2反应制Cl2: MnO2+2H++2Cl-  Cl2↑+Mn2++H2O Cl2↑+Mn2++H2O |
| D.用FeCl3溶液腐蚀印刷电路板: |
Fe3++Cu===Fe2++Cu2+