下列叙述中,正确的是
| A.硅化学性质很稳定,因此硅在自然界中以游离态形式存在 |
| B.实验结束后,将废液倒入下水道排出实验室,以免污染实验室 |
| C.实验室盛装NaOH溶液的试剂瓶要用橡皮塞而不用玻璃塞 |
| D.向待测液先滴加新制氯水再滴加KSCN溶液,溶液变成血红色,说明待测液中一定有Fe2+ |
在下列装置中,MSO4和NSO4是两种常见金属的易溶盐。当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是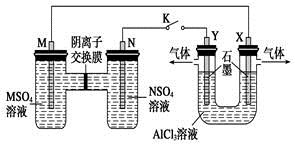
| A.溶液中c(M2+)减小 |
| B.N的电极反应式:N=N2++2e- |
| C.X电极上有H2产生,发生还原反应 |
| D.反应过程中Y电极周围生成白色胶状沉淀 |
将气体A2和B2以等物质的量充入密闭容器,一定条件下发生反应生成C气体。平衡时测得c(A2)= 0.58 mol/L,c(B2)=0.16 mol/L,c(C)=0.84 mol/L,则C的分子式为
A.ABB.AB2C.A2B D.A2B3
在含有n mol FeI2的溶液中通入Cl2,有x mol Cl2发生反应。下列说法正确的是
A.当x ≤ 时,反应的离子方程式为:2Fe2++ Cl2 → 2Fe3++ 2Cl- 时,反应的离子方程式为:2Fe2++ Cl2 → 2Fe3++ 2Cl- |
| B.当x ≥ n时,反应的离子方程式为:2Fe2++ 2I-+ 2Cl2 → 2Fe3++ I2+ 4Cl- |
| C.当Fe2+和I-同时被氧化时,x与n的关系为x>n |
| D.当x=n时,反应后氧化产物的物质的量为n mol |
在0.1 mol/L的NaHSO3溶液中有如下关系:c(Na+)>c(HSO3-) >c(SO32-) >c(H2SO3),向NaHSO3溶液中慢慢地加入少量的NaOH溶液,发生的主要反应的离子方程式为
A.SO32-+H2O HSO3-十OH— HSO3-十OH— |
B.HSO3-十H2O H2SO3十OH- H2SO3十OH- |
C.HSO3-十OH— SO32—十H2O SO32—十H2O |
D.H2SO3+OH- HSO3-十H2O HSO3-十H2O |
如图是工业制纯碱的部分物质转化示意图,下列推测错误的是
| A.若是联碱法,溶液c可在转化流程中循环利用 |
| B.若是氨碱法,则L的主要成分是NaCl |
| C.M可在转化流程中循环利用 |
| D.X是NH3,Y是CO2 |