铜及其化合物在工农业生产及日常生活中应用非常广泛。某研究小组用粗铜(含杂质铁)制备氯化铜晶体(CuCl2.2H2O)的流程如下。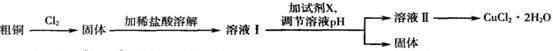
已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
请回答下列问题:
(1)溶液I中加入试剂X可以调节溶液pH,从而除去Fe3+且不引入杂质。
①试剂X可选用下列物质中的__________(填代号)。
a.CuO b.NaOH c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是__________。
(2)由溶液Ⅱ制备CuCl2.2H2O的操作依次为:边滴加浓盐酸边加热浓缩、__________(填操作名称)、过滤、洗涤干燥。
(3)向溶液Ⅱ中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因:__________.
(4)某学习小组用碘量法测定CuCl2.2H2O样品的纯度(杂质不与发生反应)。实验如下:
a.准确称取CuCl2.2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250 mL待测溶液。(已知: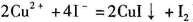 )
)
b.移取25. 00 mL待测溶液于锥形瓶中,加几滴指示剂,用c mol Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V mL。 (已知:
Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V mL。 (已知: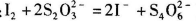 )
)
①实验中使用的指示剂名称为____________。
②达到滴定终点时,仰视滴定管读数将使测定结果_________(填“偏高”、“偏低”或“无影响”)。
③该样品中CuCl2.2H2O 的质量分数为_________(用含m、c、V的代数式表示,不用化简)。
聚合氯化铝是一种新型净水剂,其中铝的总浓度(用AlT表示)包括三类‘“主要为Al3+的单体形态铝总浓度(用Ala表示);主要为[AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝总浓度(用A1c表示)。
(1)一定条件下,向1.0 mol/LAlCl3溶液中加入0.6 mol/L的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液。写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:_____________________。
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝中铝形态分布(百分数)如下表:
| AlT/(mol·L-1) |
Ala/% |
Alb/% |
A1c/% |
| 0.208 |
1.4 |
86.6 |
12.0 |
| 0.489 |
2.3 |
86.2 |
11.5 |
| 0.884 |
2.3 |
88.1 |
9.6 |
| 1.613 |
3.1 |
87.0 |
9.9 |
| 2.520 |
4.5 |
88.2 |
7.3 |
①在一定温度下,AlT越大,pH(填“越大”、“越小”或“不变”)。
②如将AlT =" 2.520" mol·L-1的聚合氯化铝溶液加水稀释,则稀释过程中主要发生反应的离子方程式:。
③膜蒸馏料液温度对铝聚合形态百分数及铝的总浓度的影响如图1。当T>80℃时,AlT显著下降的原因是。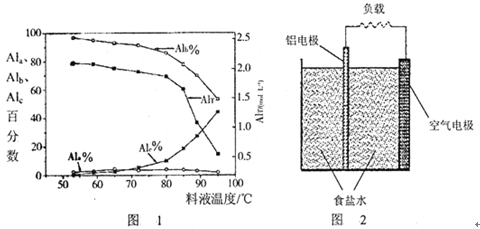
(3)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s) = 3AlCl(g)+3CO(g)△H1 =" a" kJ·mol-1
②3AlCl(g) =" 2Al(l)+" AlCl3(g)△H2 =" b" kJ·mol-1
则反应Al2O3(s)+ 3C(s) =" 2Al(l)+" +3CO(g)△H = kJ·mol-1(用含a、b的代数式表示)。反应①常压下在1900℃的高温下才能进行,说明△H0(填“>”“=”或“<”)。
(4)一种铝空气电池结构如图2所示,写出该电池正极的电极反应式。
一水草酸钙(CaC2O4·H2O)可用作分离稀有金属的载体。其制备方法如下:
步骤I:用精制氯化钙稀溶液与草酸溶液共热反应,过滤,将固体溶于热盐酸中。
步骤Ⅱ:加氨水反应得一水草酸钙沉淀,过滤,热水洗涤,在105℃干燥得产品。
(1)写出步骤Ⅱ发生反应的化学方程式。
(2)已知CaC2O4·H2O的Ksp = 2.34×10-9,为使步骤Ⅱ溶液中c(C2O42-)≤1×10-5 mol·L-1,c(Ca2+)的范围为。
(3)为研究一水草酸钙的热分解性质,进行如下实验:准确称取36.50g样品加热,样品的固体残留率( )随温度的变化如下图所示。
)随温度的变化如下图所示。
①300℃时残留固体的成分为,900℃时残留固体的成分为。
②通过计算求出500℃时固体的成分及质量。(写出计算过程)
(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
①当温度由T1变化到T2时,平衡常数关系K1K2(填“>”,“<”或“=”),焓变△H0。(填“>”或“<”)
②该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为。
③T1温度下该反应的化学平衡常数K1=。
(2)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),此反应的△S0(填“>”或“<”)。若已知:①N2(g)+3H2(g)=2NH3(g)△H=a kJ/mol②2H2(g)+O2(g)=2H2O(l)△H=b kJ/mol
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)的△H=(用含a、b的式子表示)。
(3)科学家采用质子高导电性的SCY陶瓷(可传递H+),实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如右图所示,则阴极的电极反应式是 。
下表列出了周期表短周期中6种元素的有关数据:
| 元素编号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| 原子半径(nm) |
0.075 |
0.110 |
0.152 |
0.071 |
0.186 |
0.099 |
| 最高价态 |
+5 |
+5 |
+1 |
0 |
+1 |
+7 |
| 最低价态 |
-3 |
-3 |
0 |
-1 |
0 |
-1 |
根据上表信息填空:
(1)写出下列编号对应元素的元素符号:②,③。
(2)元素④在周期表中的位置是。
(3)元素⑤形成的两种常见氧化物的化学式分别为,其中都含有的化学键是。
(4)①的氢化物和⑥的氢化物反应的化学方程式为。
高纯度氧化铝有广泛的用途,某研究小组研究用以下流程制取高纯度氧化铝:
根据上述流程图填空:
(1)“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式。
(2)通常条件下Ksp〔Fe(OH)3〕=4.0×10—38,除杂后溶液中c(Fe3+)约为。
(3)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是。
(4)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干的原因是。
(5)“分离”操作的名称是(填字母代号)。
A.蒸馏 B.分液 C.过滤
(6)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,在0.1mol/L铵明矾的水溶液中,离子浓度最大的离子是,离子浓度最小的离子是。