下列叙述正确的是
| A.95℃纯水的pH<7,说明加热可导致水呈酸性 |
| B.25℃时,在纯水中加入强碱溶液不会影响水的离子积常数 |
| C.pH=3的醋酸溶液加水稀释10倍后pH=4 |
| D.pH=3和pH=5的盐酸各10mL混合所得溶液的pH=4 |
常温下,下列各组离子在指定溶液中可能大量存在的是
| A.由水电离出来的c(H+)=10-12 mol·L-1的溶液中:Cl-、CO32-、K+、SO32- |
| B.含有大量AlO2-的溶液中:K+、Al3+、Br-、HCO3- |
| C.使甲基橙变红的溶液中:Fe2+、K+、NO3-、SO42- |
| D.使pH试纸变深蓝色的溶液中:Cl-、K+、Mg2+、SO32- |
下列物质的水溶液在蒸发皿中加热蒸干灼烧,能得到原物质的是
①NaAlO2②FeCl3③硫酸铝④绿矾⑤高锰酸钾⑥硝酸银⑦碳酸氢钙⑧蛋白质 ⑨Na2SO3⑩CaCl2
| A.①③⑤⑥⑧⑩ | B.②③④⑤⑨⑩ | C.③⑤⑦⑩ | D.①③⑩ |
下列有关说法正确的是
| A.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| B.所有的化学反应都需要一定的活化能来推动 |
C.CH3COOH 溶液加水稀释后,溶液中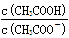 的值增大 的值增大 |
| D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH 减小 |
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断正确的是
| A.与NaOH反应的氯气一定为0.3 mol |
| B.若反应中转移的电子为n mol,则0.15<n<0.25 |
| C.n(Na+):n(Cl-)可能为7:3 |
| D.n(NaCl):n(NaClO):n(NaClO3)可能为8:2:1 |
向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成与溶解的pH列于下表。以下推断错误的是
| A.C点的沉淀为:Fe(OH)3和 BaSO4 |
| B.OA段可能发生的反应有:3Ba2++6OH-+3SO42-+Al3++Fe3+→3BaSO4↓+Fe(OH)3↓+Al(OH)3↓ |
| C.AB段可能发生的反应是:2SO42-+2Ba2++Al3++3OH-→2BaSO4↓+Al(OH)3↓ |
| D.据图计算原溶液中c(Cl-)=c(SO42-) |