向足量H2SO4溶液中加入100mL 0.4 mol·L—1 Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4 mol·L—1 HCl溶液时,放出的热量为2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为
| A.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-2.92kJ·mol—1 |
| B.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-0.72kJ·mol—1 |
| C.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-73kJ·mol—1 |
| D.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-18kJ·mol—1 |
可逆反应A(?)+aB(g) 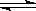 C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图所示。下列说法不正确的是()
C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图所示。下列说法不正确的是()
| A.若a=2,则A为液态或固体 |
| B.该反应的正反应为放热反应 |
| C.T2>T1,P2>P1 |
| D.其他条件不变,增加B的物质的量,平衡正向移动,平衡常数K增大 |
已知反应2HI(g)  H2(g)+I2(g); △H>0,在某一密闭容器中,充入一定量的HI气体,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是()
H2(g)+I2(g); △H>0,在某一密闭容器中,充入一定量的HI气体,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是()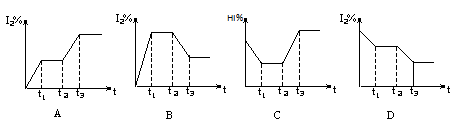
体积完全相同的恒容容器A和B,已知A装有SO2和O2各1g,B装有SO2和O2各2g,在相同温度下反应达到平衡时A中SO2的转化率为a%,B中SO2的转化率为b%,则A、B两容器中SO2转化率的关系正确的是()
A.a%>b%B.a%=b% C.a%<b%D.2a% = b%
电解质溶液有许多奇妙之处,你只有深入思考,才能体会到它的乐趣。下列关于电解质溶液的叙述中正确的是()
| A.Na2CO3、NaHCO3两种盐溶液中,离子种类不相同 |
| B.常温下,1mol/L的CH3COOH溶液与1mol/L的NaOH溶液等体积混合,所得混合液中:c(Na+) >c(CH3COO-) >c(H+)>c(OH-) |
| C.物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者小于后者 |
| D.常温下,某溶液中有水电离出的c(H+)=10-51mol·L-1,则此溶液可能是盐酸 |
草酸(H2C2O4)是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1 KHC2O4溶液中,下列关系正确的是()
| A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-) |
| B.c(HC2O4-)+c(C2O42-) =" 0.1" mol·L-1 |
| C.c(C2O42-) < c(H2C2O4) |
| D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-) |