(1)现有NH4Cl和NH3·H2O组成的混合溶液,若其pH=7,则该溶液中c(NH4+)___c(Cl-);若pH>7,则该溶液中c(NH4+)______c(Cl-)。(填“>”、“<”、“=”).
(2)0.1mol/L的NaHCO3溶液中,按物质的量浓度由大到小顺序排列该溶液中各种微粒(水分子除外) ,c(Na+)+c(H+)=_______________ ,c(Na+)=____________
结合元素周期表回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界。
(2)表中所列元素,属于短周期元素的有________,属于主族元素的有________;g元素位于第________周期第________族;i元素位于第________周期第________族。
(3)元素f是第________周期第________族元素,请在右边方框中按氦元素的式样写出该元素的原子序数、元素符号、元素名称、相对原子质量
A、B、C为短周期元素,在周期表中所处的位置如图所示。
| A |
C |
|
| B |
A、C两元素的原子核外电子数之和等于B原子的质子数。
(1)写出A、B元素的名称________、________。
(2)B位于元素周期表中第________周期第________族。
(3)C的原子结构示意图为________。
(4)写出A的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式________________________________________________________________。
下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
(1)写出元素符号和名称:
①________,②________,⑧________,⑨________。
(2)写出下列反应的化学方程式:
⑦单质跟④的氢氧化物溶液反应:______________________________
⑤的氧化物跟④的氢氧化物溶液反应:________________________________
⑥的单质在③的单质中燃烧:_____________________________________。
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。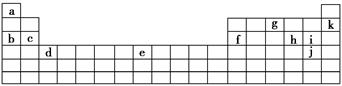
用上表中的字母代号回答下列问题:
(1)属于卤族元素的有_________________________________________;
(2)属于稀有气体元素的有_____________________________________;
(3)属于第ⅠA金属元素的有___________________________________;
(4)写出c元素在周期表中的位置_______________________________。
MgSO4·7H2O医药上用作泻剂。工业上用氯碱工业的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。主要工艺如下:
(1)用硫酸调整溶液pH为1~2,硫酸的作用是________________________________________。
(2)加次氯酸钠溶液至pH为5~6并加热煮沸约5~10 min,滤渣中主要含MnO2和另两种沉淀:__________________、____________(写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为___________________________
(3)若除杂后过滤,发现滤液发黄,需采取的措施是________
(4)过滤后晶体常用丙酮代替蒸馏水洗涤的目的是________________________________________
(5)晶体中结晶水含量的测定:准确称取0.20 g MgSO4·7H2O样品,放入已干燥至恒重的瓷坩埚中,置于马沸炉中,在200 ℃脱水1 h。为准确确定脱水后的质量,还需要经过的操作有冷却(干燥器中)至室温→___________________________
(6)硫酸根离子质量分数的测定:准确称取自制的样品0.50 g,用200 mL水溶解,加入2 mol·L-1 HCl溶液5 mL,将溶液加热至沸腾,在不断搅拌下逐滴加入5~6 mL 0.5 mol/L BaCl2溶液,充分沉淀后,得沉淀0.466 g,则样品中w(SO42-)=________________。
(7)已知:Na2CO3·10H2O (s)=Na2CO3(s)+10H2O(g)ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g)ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式____________。