在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为
C分别在三种不同实验条件下进行,它们的起始浓度均为 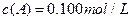 、
、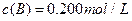 及
及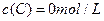 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。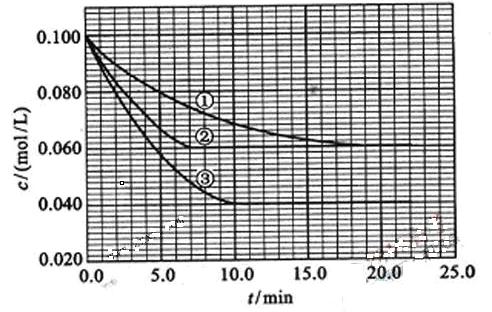
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
② ;
③ 
(2)实验②平衡时B的转化率为 _________;实验③平衡时C的浓度为____________;
(3)该反应的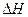 ____
____ _____0,判断其理由是_____________________;
_____0,判断其理由是_____________________;
(4)该反应进行到4.0min时的平均反应速率:
实验②: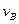 =;
=;
实验③: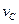 =____________________。
=____________________。
标准状况下1.68 L无色可燃气体在足量氧气中完全燃烧。若将产物通入足量澄清石灰水中,得到的白色沉淀质量为15.0 g;若用足量碱石灰吸收燃烧产物,质量增加9.3 g。
(1)燃烧产物中生成水的质量是___________。
(2)若原气体是单一气体,则它的分子式是_____________________。
(3)若原气体是两种等物质的量的气体的混合物,其中只有一种是烃,请写出它们的分子式(只要求写出两组)___________________。
均衡的膳食结构可以保障身体健康。
(1)如果人体缺少易患夜盲症的维生素是 。
(2)碳酸镁可治疗胃酸过多的原理是_____ __(用离子方程表示)。
(3)油脂在人体内通过水解生成 和甘油,再氧化分解,为人体提供能量。
(4)发育出现障碍,患营养缺乏症,这主要是由于摄取_________(填“蛋白质”、“脂肪”或“糖类”)不足引起的。下列食物中富含该物质的是 (填字母)。
| A.菠菜 | B.花生油 | C.瘦肉 | D.西瓜 |
实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%~30%的稀硫酸溶液,在50℃~80℃水浴中加热至不再产生气泡.将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口、静置、冷却一段时间后有浅绿色晶体析出,收集产品。
(1)写出该实验制备硫酸亚铁的化学方程式:________________;
(2)采用水浴加热的原因是___________________;
(3)反应时铁屑过量的目的是(用离子方程式表示)_________________;
(4)溶液趁热过滤的原因是__________________;
(5)塞紧试管口的目的是 。
已知某有机物的结构简式为: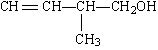
(1)该有机物中所含官能团的名称是______ 、_________。
(2)该有机物发生加成聚合反应后,所得产物的结构简式为 。
(3)写出该有机物发生消去反应的化学方程式(注明反应条件):____________。
如图是某种只含有C、H、O、N的有机物简易球棍模型。请回答下列各题。
(1)该分子属氨基酸,其分子式为________。
(2)在一定条件下,该分子可以通过聚合反应生成________(填“糖类”“油脂”或“蛋白质”)。
(3)在一定条件下,该分子可以与乙醇发生反应,请写出该反应的化学方程式_________。