有机物G是制备液晶材料的中间体之一,其结构简式为: G的一种合成路线如下:
G的一种合成路线如下:
其中,A~F分别代表一种有机化合物,合成路线中的部分产物及反应条件已略去。
已知:X的核磁共振氢谱只有1种峰;RCH=CH2 RCH2CH2OH;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。请回答下列问题:
RCH2CH2OH;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。请回答下列问题:
(1)A的结构简式是 ;C中官能团的名称是 。
(2)B的名称是 。第①~⑦步中属于取代反应的有 (填步骤编号)。
(3)写出反应⑤的化学方程式: 。
(4)第⑦步反应的化学方程式是 。
(5)G经催化氧化得到Y(C11H12O4),写出同时满足下列条件的Y的所有同分异构体的结构简式 。
a.苯环上的一氯代物有2种;b.水解生成二元羧酸和醇。
从能量的角度看,断开化学键需要________,形成化学键需要________。
某研究性学习小组为了研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
实验选用细铜丝、98.3%H2SO4、品红溶液、澄清石灰水、CC14、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。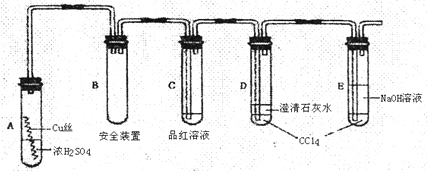
以下是该学习小组部分交流记录及后续探究实验的记录。
材料一:小组交流滴录
学生1:加热前,无现象发生;加热后,液面下铜丝变黑,产生气泡,有细小黑色颗粒状物质从铜丝表面进入浓硫酸中,黑色物质是什么?值得探究!
学生2:我也观察到黑色颗粒状物质,后来逐渐转变为灰白色固体,我想该灰白色固体极有可能是未溶于浓硫酸的CuSO4。
学生3:你们是否注意到液面以上的铜丝也发黑,而且试管上部内壁有少量淡黄色S固体凝
聚,会不会液面以上的铜丝与硫发生了反应,我查资料发现:2Cu+S=Cu2S(黑色)。
材料二:探究实验剪辑
实验1:将光亮的铜丝在酒精灯火焰上灼烧变黑,然后插入稀硫酸中,铜丝重新变得光亮,溶液呈蓝绿色;将光亮的铜丝置入加热的硫蒸气中变黑,然后插入稀硫酸中无变化。
实验2:截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化;将浓硫酸液面下方变黑的铜丝,插入稀硫酸、黑色明显变浅,溶液呈蓝绿色。
实验3:将溶液中的黑色颗粒状物质,经过滤、稀硫酸洗、蒸馏水洗、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量减少10%左右。
根据上述材料回答下列问题:
(1)D、E两支试管中CC14的作用是;
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:;
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。学生1猜想是由于SO2溶解度较大,生成了Ca(HSO3)2的缘故。请你设计实验验证学生1的猜想
;
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是;(写化学式)
(5)反应完全后稀释溶液呈酸性,学生2猜想反应中浓硫酸可能过量,请你设计一个简单的实验以验证稀释后的溶液由于硫酸过量呈酸性,。
(10分)有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
| 元素编号 |
元素特征信息 |
| A |
其单质是密度最小的物质 |
| B |
阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C |
其阳离子与B的阴离子有相同的电子层结构, 且与B可以形成两种离子化合物 |
| D |
其氢氧化物和氧化物都有两性,与C同周期 |
| E |
与C同周期,原子半径在该周期最小 |
回答下列问题:
(1)、写出下列元素的名称:B、_______,C、_______ ,D、_______,E、________;
(2)、写出A、B、C形成的化合物M的电子式;
(3)、实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为________;
(4)、E单质与M的水溶液反应的离子方程式:。
下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
 族 族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
① |
⑥ |
② |
|||||
| 三 |
③ |
⑤ |
④ |
⑩ |
⑦ |
⑧ |
||
| 四 |
⑨ |
(1)、在这些元素中,化学性质最不活泼的原子的原子结构示意图为______________;
(2)、地壳中含量最多的金属元素是________,写出元素⑥③以原子个数比1:1形成化合物的电子式__________;
(3)、这些元素中的最高价氧化物对应的水化物中,酸性最强的是 ,碱性最强的是;
(4)、写出②.⑦.⑩对应离子还原性由强到弱的次序。
(1) 用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用。例如:
①、计算机芯片的主要成分是,(填名称)
②、光导纤维的主要成分是;(填名称)
(2)硅是地壳中含量很高的元素,其单质和化合物在新型和传统非金属材料中用途广泛
①、写出工业上用碳单质还原二氧化硅制备硅的化学反应方程式;
_________________________________________________________,
②、用方程式表示为什么不能用有玻璃塞的试剂瓶存放碱性溶液
。