(1)25℃时,pH=12.0的KOH溶液中,由水电离出的c(OH-)=_______mol/L;pH=12.0的K2CO3溶液中,由水电离出来的c(OH-)=_______mol/L。
(2)常温下0.1mol·L-1 CH3COONa溶液PH=8
①用离子方程式表示CH3COONa溶液PH=8的原因: 。
②按物质的量浓度由大到小顺序排列该溶液中各种微粒(水分子除外) 。
(3)FeCl3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): 。
A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;
D与A同主族,且与E同周期;E 元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。
元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。
请回答下列问题:
(1) X的化学式为______,D的原子结构示意图为______。
(2)元素的非金属性C______E(填“>”、“<”或“=”),下列各项中,能说明这一结论的事实有______(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
(3)将由BC和BC2组成的混合气体通入下图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。
已知(ⅰ)浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC。
(ⅱ) NaOH溶液与BC2反应的化学方程式为:
2NaOH+2BC2==NaBC2+NaBC+H2O
NaOH溶液与BC气体不反应
a. 装置①、②、③中盛放的药品依次是______、______、______。
b. 通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是______(填一种气体的化学式)。
c. 能够说明实验已成功的现象是___________________________。
肉桂酸甲酯是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。它的分子式为C10H10O2,其结构和性质如下表所示:
| 结构 |
分子中只含有一个苯环,苯环上只有一个取代基且无支链,且取代基上含有碳碳双键 |
| 性质 |
 ①能使溴水因发生化学反应而褪色 ①能使溴水因发生化学反应而褪色②在NaOH溶液中易发生水解反应生成具有剧毒的醇类物质 |
试回答下列问题:
(1)肉桂酸甲酯的结构简式为。
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构 模型如右图所示(图中球与球之间的连线表示单键或双键)。
模型如右图所示(图中球与球之间的连线表示单键或双键)。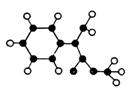
用芳香烃A为原料合成G的路线如下: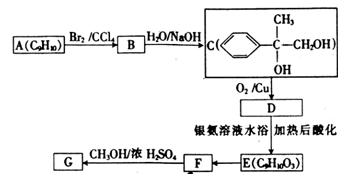
①化合物E中的官能团有(填名称)。
②A→B的反应类型是, E→F的反应类型是。
E→F的反应类型是。
③写出下列反应的化学方程式:
C→D:;
F→G:;
④E有多种同分异构体,其中有一类可用通式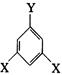 表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的其中两种物质的结构简式:
表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的其中两种物质的结构简式:
。
X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4。
请回答:
(1)X的电子式;若实验室用如图所示装置制取X,则制取X的化学反应方程式为。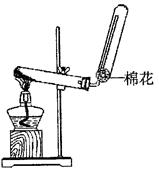
(2)已知:W+X+H2O一白色沉淀,为进一步确定W,
进行如下实验,请补全实验操作、现象和结论:
取上述白色沉淀少量置于试管中,
。
(3)常温下,取10 mL pH=a的Y的稀溶液,加水稀释时pH随溶液体积的变化如图所示,则Y的化学式为,下列叙述正确的是(选填字母)。
a.Y的水溶液可用作刻蚀玻璃
b.相同温度时与相同浓度的盐酸比较,Y的水溶液的导电能力弱
c.稀释后,阴离子的物质的量浓度之和增大
(4)分子Z中所含元素对应的单质A及A与B形成的化合物可进行如下转化: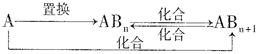
当n=1时,请写出A—ABn的化学方程式(写出一个即可)。
常温下,将某一元酸HA和 NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号[ |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0. 1 1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸___________________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等 于0.2________(选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是________________
于0.2________(选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是________________
____________________________
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________________________________
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1。
写出该混合溶液中下列算式的精确结果(不能做近似计算)。
c(Na+)-c(A-)=________mol·L-1c(OH-)-c(HA)=________mol·L-1
氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程示意图如下所示,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上电极反应为__________________,与电源负极相连的电极附近,溶液pH_________(选填“不变”、“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为_________
_______________________________________________________________。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂不能是_________。
a. Ba(OH)2 b. Ba(NO3)2c. B aCl2
aCl2
(4)为了有效除去Ca2+、Mg2+、SO42-,加入试剂不合理的顺序为_______(选填a、b、c)
a. 先加 NaOH,后加Na2CO3,再加钡试剂
NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂,再加Na2CO3
c. 先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过_________、冷却、_________(填写操作名称)除去NaCl。