在室温下,下列五种溶液:
① 0.1 mol/L CH3COONa ②0.1 mol/L CH3COONH4
③0.1 mol/L NH4HSO4
④0.1 mol/L NH3·H2O和0.1 mol/L NH4Cl等体积混合
⑤0.1 mol/L NH3·H2O ⑥0.1 mol/L NH4Cl
请根据要求填写下列空白:
(1)溶液①呈 (填“酸性”、“碱性”或“中性”),其原因是 (用离子方程式表示)。
(2)比较溶液②和③,其中c(NH4+)的大小关系是②______③(填“>”、“<”或“=”)。
(3)在混合液④中,c(Cl-)="________" mol/L;c(NH3·H2O)+ c(NH4+)______ 0.2 mol/L(填“>”、“<”或“=”)。
(4)室温下,一定体积的溶液⑤和溶液⑥混合后所得溶液的pH=7,则溶液中离子浓度的大小关系是: 。
氮化钠(Na3N)是科学家制备的一种重要化合物。它与水作用可生成NH3 和一种强碱。回答下列问题:
(1)氮化钠的电子式是,该化合物是化合物(选填“离子”、“共价”)。
(2)氮化钠与水反应的化学方程式是,该反应属于反应。
(3)氮化钠与盐酸反应生成种盐,其中(填盐的化学式)既含离子键又含有共价键。
(4)氮化钠中两种微粒的半径大小比较:r(Na+)r(N3-)(填“大于”、“小于”或“等于”)。
四种短周期非金属元素A、B、C、D,原子序数依次增大。A是原子半径最小的元素, B原子的最外层电子数是次外层电子数的两倍,D在地壳中含量最大。请回答:
(1)B元素的原子结构示意图是__________。
(2)化合物CA3的电子式是______________。
(3)BD2与淡黄色固体反应生成D2的反应方程式:_____________________。
(4)丙为含有上述四种元素的常见无机酸式盐,则丙的化学式为__________。
用电子式表示下列化合物的形成过程
(1)H2S:;
(2)MgF2:。
为提纯下表所列有机物(括号内为所含的少量杂质),从(I)中选择适宜的试剂,从(II)中选择最佳提纯的方法,将序号填入表中。
(I)试剂:
a.浓硫酸
b.氢氧化钠
c.生石灰
d.碳酸钠
e.水
f.浓溴水
(II)方法:
| A.过滤 | B.分液 | C.蒸馏 | D.蒸发 |
| 要提纯的物质 (少量杂质) |
溴乙烷 (乙醇) |
乙醇 (水) |
乙酸乙酯 (乙酸) |
苯 (苯酚) |
| (1)选用试剂 |
||||
| (2)分离方法 |
(3)在B的操作中,使用的主要玻璃仪器是____________________________。
食品安全关系国计民生,影响食品安全的因素很多。
(1)聚偏二氯乙烯(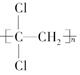 )具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
)具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
(2)劣质植物油中的亚油酸[CH3(CH2)4—CH===CH—CH2—CH===CH—(CH2)7COOH]含量很低。下列关于亚油酸的说法中,正确的是_________。
| A.分子式为C18H34O2 |
| B.一定条件下能与乙酸发生酯化反应 |
| C.能和NaOH溶液反应 |
| D.能使酸性KMnO4溶液褪色 |
(3)假酒中甲醇(CH3OH)含量超标,请写出Na和甲醇反应的化学方程式:_________________。
(4)三类营养物质之一的淀粉最终的水解产物是葡萄糖。请设计实验证明淀粉已经全部水解,写出操作、现象和结论:______________________________________________。