甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料。以CH4和H2O为原料制备甲醇和二甲醚的工业流程如下: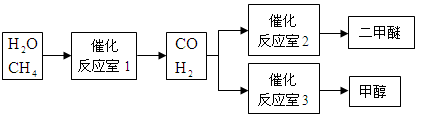
根据要求回答下列问题:
(1)“反应室1”在一定条件下反应的化学方程式为 。
(2)水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g) ΔH= -90.8kJ·mol-1
CH3OH(g) ΔH= -90.8kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH= -23.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH= -41.3kJ·mol-1
CO2(g)+H2(g) ΔH= -41.3kJ·mol-1
完成热化学反应方程式:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g);ΔH= 。
CH3OCH3(g)+CO2(g);ΔH= 。
(1)某工厂每天要烧掉含硫1.6%的烟煤200 t,排放出的SO2会严重污染环境,如果变废为宝,将这些SO2回收利用,那么理论上每年(按365 d计)可生产98%的浓硫酸 吨;
(2)若要在铁制件表面镀镍,则镍应与电源的 极相连,电镀液可以用硫酸镍溶液,电镀过程中硫酸镍溶液的浓度会 (填“增大”“减小”或“不变”);
(3)工业上制造水泥、玻璃时都要用到的原料是 (填编号),用所选原料制玻璃的化学方程式是 ;
| A.纯碱 | B.熟石灰 | C.石灰石 | D.黏土 |
(4)炼铁和炼钢过程的主要区别是 ;
(5)明矾净化水的原理是
(用离子方程式表示);具有暂时硬度的水中除去Mg2+的方法是 、
(用化学方程式表示)。
工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)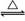 Si3N4(s)+12HCl(g) ΔH<0
Si3N4(s)+12HCl(g) ΔH<0
某温度和压强条件下,分别将0.3 mol SiCl4(g)、0.2 mol N2(g)、0.6 mol H2(g)充入2 L密闭容器内,进行上述反应,5 min达到平衡状态,所得Si3N4(s)的质量是5.60 g。
(1)H2的平均反应速率是 mol·L-1·min-1。
(2)平衡时容器内N2的浓度是 mol·L-1。
(3)SiCl4(g)的转化率是 。
(4)若按n(SiCl4)∶n(N2)∶n(H2)=3∶2∶6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应 (填“增大”“减小”或“不变”)。
(5)在不改变反应条件的情况下,为了提高SiCl4(g)的转化率,可通过改变投料配比的方式来实现。下列四种投料方式,其中可行的是 。
| 选项 |
投料方式 |
| A |
n(SiCl4)∶n(N2)∶n(H2)=1∶1∶2 |
| B |
n(SiCl4)∶n(N2)∶n(H2)=" " 1∶2∶2 |
| C |
n(SiCl4)∶n(N2)∶n(H2)=" " 3∶2∶2 |
| D |
n(SiCl4)∶n(N2)∶n(H2)=" " 2∶1∶3 |
(6)达到平衡后升高温度,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
A.c(HCl)减少
B.正反应速率减慢,逆反应速率加快
C.Si3N4的物质的量减小
D.重新平衡时c(H2)/c(HCl)增大
工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯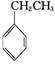 (g)+CO2(g)
(g)+CO2(g)
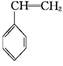 (g)+CO(g)+H2O(g) ΔH="-166" kJ·mol-1
(g)+CO(g)+H2O(g) ΔH="-166" kJ·mol-1
(1)①乙苯与CO2反应的平衡常数表达式为:K= 。
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。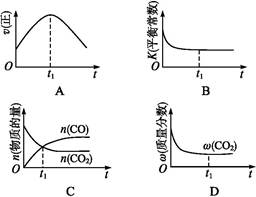
(2)在3 L密闭容器内,乙苯与CO2的反应在三种不同的条件下进行实验,乙苯、CO2的起始浓度分别为1.0 mol·L-1和3.0 mol·L-1,其中实验Ⅰ在T1℃,0.3 MPa,而实验Ⅱ、Ⅲ分别改变了实验其他条件;乙苯的浓度随时间的变化如图1所示。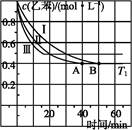
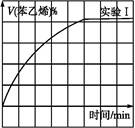
图1图2
①实验Ⅰ乙苯在0~50 min时的反应速率为 。
②实验Ⅱ可能改变的条件是 。
③图2是实验Ⅰ中苯乙烯体积分数V%随时间t的变化曲线,请在图2中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线。
(3)若实验Ⅰ中将乙苯的起始浓度改为1.2 mol·L-1,其他条件不变,乙苯的转化率将 (填“增大”“减小”或“不变”),计算此时平衡常数为 。
已知反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH="a" kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)
FeO(s)+CO(g) ΔH="a" kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g) CO2(g) ΔH="b" kJ·mol-1;反应③Fe2O3(s)+3CO(g)
CO2(g) ΔH="b" kJ·mol-1;反应③Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH="c" kJ·mol-1。测得在不同温度下,K值如下:
2Fe(s)+3CO2(g) ΔH="c" kJ·mol-1。测得在不同温度下,K值如下:
| 温度/℃ |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2.40 |
(1)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为 。
(2)反应①为 (选填“吸热”或“放热”)反应。
(3)700 ℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有 (填序号)。
A.缩小反应器体积 B.通入CO2 C.温度升高到900 ℃ D.使用合适的催化剂
E.增加Fe的量
(4)下列图像符合反应①的是 (填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2)。
(5)由反应①和②可求得,反应2Fe(s)+O2(g) 2FeO(s)的ΔH= 。
2FeO(s)的ΔH= 。
(6)请运用盖斯定律写出Fe(固体)被O2(气体)氧化得到Fe2O3(固体)的热化学方程式: 。
甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如下图。
CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如下图。
①已知100 ℃压强为p1时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为 。
②图中的p1 p2(填“<”“>”或“="”),100" ℃压强为p2时平衡常数为 。
③该反应的ΔH 0(填“<”“>”或“=”)。
(2)在一定条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g) CH3OH(g) ΔH<0 ……Ⅱ
CH3OH(g) ΔH<0 ……Ⅱ
①若容器容积不变,下列措施可增加甲醇产率的是( )
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验表格中。
A.下表中剩余的实验条件数据:a= ;b= 。
。
B.根据反应Ⅱ的特点,下图是在压强分别为0.1 MPa和5 MPa下CO的转化率随温度变化的曲线图,请指明图中的压强px= MPa。
| 实验编号 |
T/℃ |
n(CO)/n(H2) |
p/MPa |
| 1 |
150 |
1/3 |
0.1 |
| 2 |
a |
1/3 |
5 |
| 3 |
350 |
b |
5 |
