酸碱中和滴定是中学化学中重要的定量实验之一。
Ⅰ.某研究性学习小组准确进行了如下实验,称取1.00g不纯的苛性钠样品配成250ml溶液,取出10.00ml,用已知浓度为0.040mol·L-1的盐酸进行滴定(杂质不与盐酸反应)。
根据要求回答下列问题:
(1)配制250 mL 0.040mol·L-1的盐酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、___________和______________。
(2)为测定该苛性钠溶液的准确浓度,几次滴定消耗盐酸的体积如下:
| 实验序号 |
1 |
2 |
3 |
4 |
| 消耗盐酸溶液的体积(mL) |
20.05 |
20.00 |
22.10 |
19.95 |
①计算苛性钠浓度时,哪次实验的数据不宜采用?答:________。(填实验序号)
②该苛性钠溶液的浓度为___________。
(3)若操作过程中未用盐酸润洗滴定管,对测定结果有怎样的影响?
答:______________________(填“偏大”、“偏小”或“无影响”)。
Ⅱ.在另一次实验中,研究性小组将V1 mL 1.0mol·L-1 HCl溶液和V2 mL 未知浓度的NaOH溶液均匀混合后,测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2="50" mL)。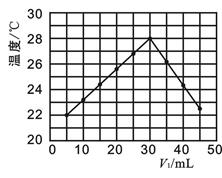
(4)下列叙述中正确的是_________
A.该实验的环境温度为22℃
B.当V1 =40时,溶液中c(Na+)<c(Cl—)
C.NaOH溶液的浓度为1.0mol·L-1
D.保持其他条件不变,只将HCl改为CH3COOH进行实验,也得到如图的实验结果
苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为: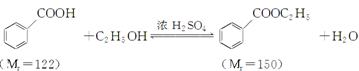
已知:
| 颜色、状态 |
沸点(℃) |
密度(g·cm-3) |
|
| *苯甲酸 |
无色、片状晶体 |
249 |
1.2659 |
| 苯甲酸乙酯 |
无色澄清液体 |
212.6 |
1.05 |
| 乙醇 |
无色澄清液体 |
78.3 |
0.7893 |
| 环己烷 |
无色澄清液体 |
80.8 |
0.7318 |
*苯甲酸在100 ℃会迅速升华。
实验步骤如下:
a.在100 mL圆底烧瓶中加入12.20 g苯甲酸、25 mL乙醇(过量)、20 mL 环己烷,以及4 mL浓硫酸,混合均匀并加入沸石,按下图所示装好仪器,控制温度在65~70 ℃加热回流2 h。反应时环己烷—乙醇—水会形成“共沸物”(沸点62.6 ℃)蒸馏出来,再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
b.反应结束,打开旋塞放出分水器中液体后,关闭旋塞。继续加热,至分水器中收集到的液体不再明显增加,停止加热。
c.将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性。
d.用分液漏斗分出有机层,水层用25 mL乙醚萃取分液,然后合并至有机层。加入氯化钙,对粗产物进行蒸馏,低温蒸出乙醚后,继续升温,接收210~213℃的馏分。
e.检验合格,测得产品体积为12.86 mL。
回答下列问题:
(1)①步骤a中使用分水器不断分离除去水的目的是__________________________。
②步骤b中应控制馏分的温度在________。
A.65~70 ℃ B.78~80 ℃ C.85~90 ℃D.215~220 ℃
③加入乙醇过量的主要原因是____________________________________。
(2)若Na2CO3加入不足,在步骤d蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是_____________________________________________________________________。
(3)关于步骤d中的分液操作叙述正确的是________。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞。将分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗下口的玻璃活塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,需将玻璃塞上的凹槽对准漏斗口上的小孔
(4)该实验的产率为________。
邻叔丁基对苯二酚(TBHQ)是一种新颖的食品抗氧剂,其制备原理如下:

实验过程中的主要步骤如下:
步骤1:向三颈烧瓶中加入5.5 g对苯二酚,5.0 mL浓磷酸及20 mL二甲苯(装置如图所示),启动搅拌器。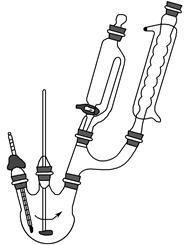
步骤2:缓缓加热到100~110 ℃,慢慢滴加7.5 mL叔丁醇和5 mL二甲苯组成的溶液,30~60 min内滴完。
步骤3:升温到135~140 ℃,恒温回流2.5 h。
步骤4:将反应液冷却到120 ℃,直到反应完成。
步骤5:将反应液倒入烧杯,并用热水洗涤三颈烧瓶,洗液并入烧杯中。
步骤6:冷却结晶,抽滤,回收滤液中的二甲苯和磷酸。
步骤7:用干甲苯重结晶、脱色、冷水洗涤、干燥。
(1)磷酸在实验中的作用是________。
(2)本实验中二甲苯的作用是_________________________________ __________________________________________________。
(3)步骤4中反应完成的标志是_________________________。
(4)步骤7脱色时,可用的脱色剂是________。
(5)对合成得到的产品表征,还需要的主要现代分析仪器是__________________________。
苯甲酸常用于抗真菌及消毒防腐。实验室常用高锰酸钾氧化甲苯制备苯甲酸,其装置如图甲所示(加热、搅拌和仪器固定装置均已略去)。实验过程如下:
①将5.4 mL甲苯、100 mL水、几粒沸石加入250 mL三颈烧瓶中;
②装上冷凝管,加热至沸后分批加入16 g高锰酸钾,回流反应4 h;
③将反应混合物趁热减压过滤,并用热水洗涤滤渣,将洗涤液并入滤液中;
④滤液加入盐酸酸化后,抽滤(装置如图乙)、洗涤、干燥得苯甲酸粗产品。
在苯甲酸制备过程中发生反应: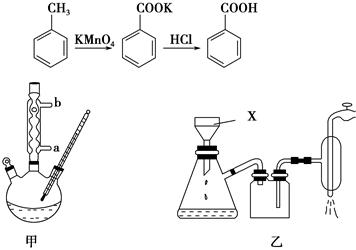
(1)图甲冷凝管中冷水应从________(填“a”或“b”)管进入,图乙中仪器X的名称为________。
(2)实验中分批加入KMnO4的原因是_________________________。
(3)判断甲苯被氧化完全的实验现象是___________________________。
(4)抽滤操作与普通过滤相比,除了得到沉淀较干燥外,还有一个优点是__________________________________________________________。
(5)第一次过滤时,若溶液呈红色,可加入下列试剂处理________(填字母)。
| A.H2O | B.CCl4 |
| C.NaHSO3 | D.HNO3 |
(6)苯甲酸在不同温度下溶解度见下表:
| T/℃ |
4 |
18 |
75 |
| 溶解度/g |
0.18 |
0.27 |
2.20 |
洗涤苯甲酸晶体时应用________洗涤。
偶氮苯是橙红色晶体,溶于乙醇,微溶于水,广泛应用于染料制造和橡胶工业,以硝基苯、镁粉和甲醇为原料制备偶氮苯的实验步骤如下:
步骤1:在反应器中加入一定量的硝基苯、甲醇和一小粒碘,装上冷凝管,加入少量镁粉,立即发生反应。
步骤2:等大部分镁粉反应完全后,再加入镁粉,反应继续进行,等镁粉完全反应后,加热回流30 min。
步骤3:将所得液体趁热倒入冰水中,并不断搅拌,用冰醋酸小心中和至pH为4~5,析出橙红色固体,过滤,用少量冰水洗涤。
步骤4:用95%的乙醇重结晶。
(1)步骤1中反应不需要加热就能剧烈进行,原因是________________。镁粉分两次加入而不是一次性全部加入的原因是___________________ _____________________________________________________。
(2)步骤3中析出固体用冰水洗涤的原因是________________。若要回收甲醇,实验所需的玻璃仪器除冷凝管、酒精灯、牛角管(应接管)和锥形瓶外还应有________________________________________________________________。
(3)取0.1 g偶氮苯,溶于5 mL左右的苯中,将溶液分成两等份,分别装于两个试管中,其中一个试管用黑纸包好放在阴暗处,另一个则放在阳光下照射。用毛细管各取上述两试管中的溶液点在距离滤纸条末端1 cm处,再将滤纸条末端浸入装有1∶3的苯环己烷溶液的容器中,实验操作及现象如下图所示:
①实验中分离物质所采用的方法是________法。
②由实验结果可知:________________;利用该方法可以提纯反式偶氮苯。
实验室用硫酸铵、硫酸和废铁屑制备硫酸亚铁铵晶体的方法如下:
步骤1:将废铁屑依次用热的碳酸钠溶液、蒸馏水洗涤。
步骤2:向盛有洁净铁屑的烧杯中加入稀H2SO4溶液,水浴加热,使铁屑与稀硫酸反应至基本不再冒出气泡为止。趋热过滤。
步骤3:向滤液中加入一定量(NH4)2SO4固体。
硫酸亚铁晶体、硫酸铵、硫酸亚铁铵晶体的溶解度(g/100 g H2O)
| 温度物理溶解度 |
0 ℃ |
10 ℃ |
20 ℃ |
30 ℃ |
40 ℃ |
50 ℃ |
60 ℃ |
| FeSO4·7H2O |
15.6 |
20.5 |
26.5 |
32.9 |
40.2 |
48.6 |
- |
| (NH4)2SO4 |
70.6 |
73.0 |
75.4 |
78.0 |
81.0 |
- |
88.0 |
| (NH4)2SO4·FeSO4·6H2O |
12.5 |
17.2 |
21.0 |
28.1 |
33.0 |
40.0 |
44.6 |
(1)步骤2中控制生成的硫酸亚铁中不含硫酸铁的方法是______________。
(2)在0~60 ℃内,从硫酸亚铁和硫酸铵的混合溶液中可获得硫酸亚铁铵晶体的原因是_______________________________________________________。
(3)为了从步骤3所得溶液中获得硫酸亚铁铵晶体,操作是___________________________。
(4)测定硫酸亚铁铵晶体中Fe2+含量的步骤如下:
步骤1:准确称取a g(约为0.5 g)硫酸亚铁铵晶体样品,并配制成100 mL溶液。
步骤2:准确移取25.00 mL硫酸亚铁铵溶液于250 mL锥形瓶中。
步骤3:立即用浓度约为0.1 mol·L-1 KMnO4溶液滴定至溶液呈稳定的粉红色,即为滴定终点。
步骤4:将实验步骤1~3重复2次。
①步骤1中配制100 mL溶液需要的玻璃仪器是___________________________________;
②为获得样品中Fe2+的含量,还需补充的实验是_________________________________。