根据下列反应判断氧化剂的氧化性由强到弱的顺序正确的是
①Cl2+2KI===I2+2KCl ②2FeCl3+2HI===I2+2FeCl2+2HCl
③2FeCl2+Cl2===2FeCl3 ④I2+SO2+2H2O===2HI+H2SO4
| A.Cl2>I2>Fe3+>SO2 | B.Fe3+>Cl2>I2>SO2 |
| C.Cl2>Fe3+>I2>SO2 | D.Cl2>Fe3+>SO2>I2 |
主族元素单质及化合物在许多性质上都存在着递变规律。下列有关说法不正确的是
| A.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深 |
| B.氧族元素氢化物稳定性按H2O、H2S、H2Se、H2Te的顺序依次减小 |
| C.氢化物的沸点按NH3、BiH3、SbH3、AsH3、PH3的顺序依次递减 |
| D.最高价氧化物对应水化物碱性按NaOH、KOH、RbOH、CsOH的顺序依次增强 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,11.2 L乙醇所含的羟基数为0.5NA |
| B.常温下,1L 0.1 mol·L-1的Na2CO3溶液中含有的离子总数为0.3NA |
| C.常温常压下,5.6g乙烯和环丙烷的混合气体中含有的碳原子数为0.4NA |
| D.电解硫酸铜溶液时,阳极每生成标准状况下3.36L气体,电路中转移电子数为0.3NA |
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e—=Li2S+Fe。有关该电池的下列说法中,正确的是
| A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价 |
| B.该电池的电池反应式为:2Li+FeS=Li2S+Fe |
C.负极的电极反应式为Al-3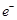 =Al3+ =Al3+ |
| D.充电时,阴极发生的电极反应式为:Li2S+Fe-2e—=2Li++FeS |
有两只密闭容器A和B,A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量SO3气体,并使A和B容积相等(如下图所示)。在保持400℃的条件下使之发生如下反应:2SO2+O2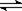 2SO3。
2SO3。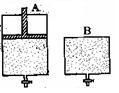
则下列描述正确的是
| A.达到平衡所需要的时间:A容器更短 |
| B.达到平衡时:B容器中SO3的转化率更大 |
| C.达到平衡时:A容器中SO2的物质的量更多 |
| D.达到平衡后,向两容器中分别通入等量的氦气,A容器中SO3的体积分数增大,B容器中SO3的体积分数不变 |
某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。当有1 mol H2O参与反应时,转移电子的物质的量为
| A.0.5 mol | B.1 mol | C.2 mol | D.4 mol |