设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.11.2 L CO2所含分子数为0.5 NA |
| B.1 L 0.1 mol·L-1的Na2S溶液中离子数为0.3 NA |
| C.0.5 mol FeBr2与足量氯气反应转移的电子数为NA |
| D.14.2 g Na2SO4固体中阴离子所带电荷数为0.2 NA |
向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,生成的沉淀质量与滴入NaOH溶液体积关系如图,则原混合溶液中MgCl2与FeCl3的物质的量之比为
A.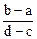 |
B.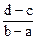 |
C.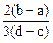 |
D.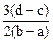 |
在标准状况下,将NO、NO2、O2三种气体按一定比例充满一固定容积的容器,并将该容器倒置在水槽中,充分反应后,容器中无气体剩余,所得溶液的浓度为Mmol/L。则M的取值范围是
| A.0<M<1/22.4 | B.1/39.2<M<1/22.4 |
| C.1/28<M<1/22.4 | D.1/39.2<M<1/28 |
下述实验不能达到预 期目的的是
期目的的是
| 编号 |
实验内容 |
实验目的 |
| A |
将SO2通入酸性KMnO4溶液中 |
证明SO2具有漂白性 |
| B |
将Cl2通入NaBr溶液中,然后加入CCl4,振荡、静置 |
比较氯与溴的氧化性强弱 |
| C |
将铜片分别与浓、稀硝酸反应 |
探究浓、稀硝酸氧化性的相对强弱 |
| D |
向盛有20g蔗糖的烧杯中加入几滴水,搅拌均匀。再加入少许浓硫酸,迅速搅拌。 |
探究浓硫酸的脱水性 |
把500 ml有BaCl2和KCl的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
| A.0.1(b-2a)mol·L-1 | B.10(2a - b)mol·L-1 |
| C.10(b-a)mol·L-1 | D.10(b-2a)mol·L-1 |
在1000K时,下列可逆反应达到平衡:CO(g)+H2O(g)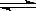 CO2(g)+H2(g);已知CO和H2O的起始浓度均为0.01mol/L,H2的平衡浓度为0.005mol/L。此时,若再充入水气0.02mol/L,使平衡移动,H2的新平衡浓度可能是
CO2(g)+H2(g);已知CO和H2O的起始浓度均为0.01mol/L,H2的平衡浓度为0.005mol/L。此时,若再充入水气0.02mol/L,使平衡移动,H2的新平衡浓度可能是
| A.0.0025mol/L | B.0.0075mol/L | C.0.01mol/L | D.0.015mol/L |