湿法炼锌为现代炼锌的主要方法,下列是以硫化锌精矿为原料制备单质锌的工业流程。
(1)烟气不能直接排放,可用于制取一种常见的强酸,该强酸为__________。
(2)浸出液以硫酸锌为主,还含有Fe3+、Fe2+、A13+、Cu2+、Cd2+、C1一等杂质,会影响锌的电解,必须除去。净化过程如下:
①在酸性条件下,用H2O2将Fe2+氧化成Fe3+,离子方程式为______________________。
②将浸出液的pH调节为5.5左右,使Fe3+、A13+形成沉淀而除去,可选用的试剂为_____(填字母)
| A.NaOH | B.NH3·H2 O | C.ZnO | D.H2 SO4 |
③用Zn除去Cu2+和Cd2+
④用Ag2SO4除去Cl一,发生的反应为Ag2SO4+2Cl一 2AgCl+ SO42-,室温下该反应的平衡常数K=_____________[已知室温下Ksp(Ag2SO4)="6.0x" 10-5,Ksp(AgCl)="2.0x" 10-10]。
2AgCl+ SO42-,室温下该反应的平衡常数K=_____________[已知室温下Ksp(Ag2SO4)="6.0x" 10-5,Ksp(AgCl)="2.0x" 10-10]。
(3)控制一定条件,用惰性电极电解硫酸锌溶液制取锌,锌在____极析出,阳极反应式为__________。
某固体混合物可能由SiO2、Fe2O3、A12O3、Na2SO3、Na2CO3中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计的部分实验方案如下图所示: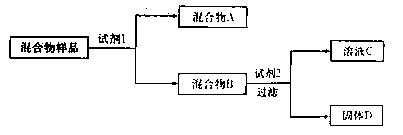
请回答下列问题:
(1)若试剂1是稀硫酸,试剂2是氢氧化钠溶液。在混合物样品中加以足量的稀硫酸后,固体全部溶解,得到混合气体A和澄清溶液B,在B中滴加过量氢氧化钠溶液时,先有沉淀生成,后沉淀部分溶解。则该混合物样品中一定不含的物质是;固体D的化学式为;检验混合物B中含有Fe3+所选用的试剂是;证明混合气体A中含有CO2的实验方法是。
(2)若试剂1是水,试剂2是氢氧化钠溶液(过量)。在混合物样品中加足量的水后过滤,混合物B是滤渣,试推断:固体D的化学式为;检验溶液C中是否含有SiO32—的实验方法是。
某混合物A ,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此回答下列问题:
(1)I、II、III、IV四步中 对于溶液和沉淀的分离采取的方法是。
对于溶液和沉淀的分离采取的方法是。
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式
固体B;沉淀C;沉淀D;溶液E。
(3)写出①、③、④三个反应方程式和②离子方程式。
① ____;② _____;
③ ____ ;④ ___。
主族元素A、B、C、D都是短周期元素,A、D同主族,B、C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体。它们在一定条 件下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能剧烈反应生成A的单质。所得溶液中含有与氖原子的电子层结构相同的阳离子。
件下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能剧烈反应生成A的单质。所得溶液中含有与氖原子的电子层结构相同的阳离子。
回答下列问题:(1)写出元素符号A____,B____,C____,D____。
(2)写出B单质与D在加热反应后生成物质的化学式___________ ___________。
___________。
写出符合下列条件的短周期元素.(提示:答案可能有多种) (6分)
①.最外层电子数是次外层电子数的1/2的元素.___________ (填元素符号,下同)
②.最外层有2个电子的元素_________________
③.M层电子数是L层电子数的3/4的元素_____________
将1mol/LNaOH溶液逐滴滴入盛有20 ml 1mol/LAlCl3溶液的试管中,边滴边振荡试管,能观察到的实验现象______________________________________,有关的化学方程式______________________________________________当加入_______mlNaOH沉淀达到最大值. (6分)
ml 1mol/LAlCl3溶液的试管中,边滴边振荡试管,能观察到的实验现象______________________________________,有关的化学方程式______________________________________________当加入_______mlNaOH沉淀达到最大值. (6分)