【化学——选修2化学与技术】
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,应用领域十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。
①步骤I中反应的化学方程式为:4FeO·Cr2O3(s)+8Na2CO3(s)+7O2= 8Na2CrO4(s)+2Fe2O3(s)+8CO2
该反应的化学平衡常数的表达式为 。在常温下该反应速度极慢,下列措施中能使反应速率增大的是 。
| A.升高温度 | B.通入过量的空气 |
| C.将原料粉碎 | D.增加纯碱的用量 |
②步骤II中所得溶液显碱性,其中除含有Na2C rO4外还含有铝、硅元素的化合物,它们的化学式可能是 。
③步骤III需将溶液的pH调至7~8并煮沸,其目的是 。
④步骤Ⅳ中发生反应的离子方程式为:____。
(2)将红矾钠与KC1固体1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体,反应方程式为:Na2CrO4 +2KCl= K2Cr2O7 +2NaCl(已知NaCl的溶解度受温度影响小,K2Cr2O7的溶解度受温度影响大),基本实验步骤为:①溶解;② ;③____ 。
④冷却、结晶,过滤,得到K2Cr2O7晶体。
完成下列各小题。
(1)系统命名: ;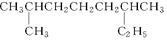
(2)写出支链只有一个乙基且式量最小的烷烃的结构简式: ;
(3)篮烷的结构如图所示: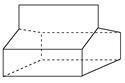
①蓝烷的分子式为________________________;
②蓝烷不具有的性质___ _____;
a.不能溶于水 b.密度大于水
c.能与溴水发生加成反应d.常温、常压下为气体
③蓝烷的一氯代物有________种。
现有下列各化合物:
(1)上述各组化合物属于同系物的是 ,属于同分异构体的是 (填入编号);
(2)A、B、C中的化合物中含有的官能团是(写名称) 、 、 、 ;
(3)根据官能团的特点可将C中两化合物划分为 类和 类。
按要求完成下列问题:
(1)甲基的电子式_____________
(2)电石气的结构式_________________
(3)相对分子质量为72且沸点最低的烷烃的结构简式_______________
(4)顺式聚1,3-丁二烯的结构简式________________
(5)与H2加成生成2,5-二甲基己烷的炔烃的系统命名_________________
(6) 的系统命名
的系统命名
NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
(1)I中,NH3和O2在催化剂作用下反应,其化学方程式是 。
(2)II中,2NO(g)+O2(g)  2NO2(g) 。起始时容器充入1molNO、0.5molO2,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如下图)。
2NO2(g) 。起始时容器充入1molNO、0.5molO2,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如下图)。
①比较p1、p2的大小关系 。
②在温度为500℃、压强为p2条件下,平衡混合气中NO2的体积分数 。
(3)III中,将NO2(g)转化成N2O4(l),再制备浓硝酸。
①已知:2NO2(g)  N2O4(g) ΔH1 2NO2(g)
N2O4(g) ΔH1 2NO2(g)  N2O4(l) ΔH2
N2O4(l) ΔH2
A B C
反应过程中能量变化正确的是 (填序号)。
②N2O4与O2、H2O化合的化学方程式 。
合成氨是人类科学技术上的一项重大突破。工业上以天然气为原料合成氨。其生产工艺如下:造气阶段→转化阶段→分离净化→合成阶段
(1)造气阶段的反应为:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.1 kJ/mol
CO(g)+3H2(g) ΔH=+206.1 kJ/mol
①在一密闭容器中进行上述反应,测得 CH4的物质的量浓度随反应时间的变化如下图1所示。反应中处于平衡状态的时间为 、 ;10 min时,改变的外界条件可能是 。
②如图2所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O。在相同温度下发生反应,并维持反应过程中温度不变。则达到平衡时,两容器中CH4的转化率大小关系为:α甲(CH4) α乙(CH4);
(2)转化阶段发生的可逆反应为: CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
一定温度下,反应的平衡常数为K=1。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO |
H2O |
CO2 |
H2 |
| 0.5 mol |
8.5 mol |
2.0 mol |
2.0 mol |
此时反应中正、逆反应速率的关系式是 (填序号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)合成氨反应为:N2(g)+3H2(g) 2NH3(g)∆H=-92.4kJ•mol ‾1
2NH3(g)∆H=-92.4kJ•mol ‾1
①依据温度对合成氨反应的影响,在下图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
②根据勒夏特列原理,简述提高合成氨原料转化率的一种方法 。
(4)工业合成氨的热化学方程式为
N2(g)+3H2(g)  2NH3(g),ΔH=-92.4 kJ·mol-1。
2NH3(g),ΔH=-92.4 kJ·mol-1。
在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
①该条件下的平衡常数为_________;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。反应放出的热量________(填“>”“<”或“=”)92.4 kJ。