[化学—选修2化学与技术](15分)
空气吹出法工艺是目前“海水提溴”的最主要方法之一,其工艺流程如下:
(1)目前,从海水中提取的溴约占世界溴年产量的 。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,其原因是 。
(3)步骤④的离子方程式为 。
(4)步骤⑥的蒸馏过程中,溴出口温度要控制在80〜90℃。温度过高或过低都不利于生产,理由是 。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差较大的特点进行分离。分离仪器的名称是 ,分离时液溴从分离器 (填“上口”或“下口")排出。
(6)不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、S02吸收、氯化”的原因是 。
(7)某同学测得苦卤中溴的含量为0.8g/L,已知步骤①〜⑥中溴共损失了25%,步骤⑦和步骤⑧又共损失了所得溴蒸气的10%,若处理10 m3这样的苦卤,可得到液溴 mol。
(12分)(1)已知C(s、金刚石)+O2==CO2(g) ΔH=-395.4kJ/mol,
C(s、石墨)+O2==CO2(g) ΔH=-393.5kJ/mol。
①石墨和金刚石相比,石墨的稳定性金刚石的稳定性。
②石墨中C-C键键能______金刚石中C-C键键能。(均填“大于”、“小于”或“等于”)。
(2)肼(N2H4)和NO2是一种双组分火箭推进剂。两物质混合发生反应生成N2和H2O(g),已知8g气体肼在上述反应中放出142kJ热量,其热化学方程式为:。
(3)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学反应方程式为:;
又知H2O(l)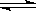 H2O(g),△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是kJ。
H2O(g),△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是kJ。
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
(1)步骤②中的BaCl2溶液能否替换成以下溶液()
| A.Ba(NO3)2溶液 | B.Ba(OH)2溶液 |
| C.A和B均可以 | D.A和B均不可以 |
(2)第④步用到的试剂作用是;
(3)利用题干所给试剂,②③④所加试剂的顺序还可以是(填化学式);
(4)判断SO42-已除尽的方法是;
(5)若先用盐酸调溶液至酸性,再过滤,将对纯度产生影响,其可能的原因是(用相应的离子方程式表示),
(至少两个)。
27.2g某二价金属的氯化物ACl2中含有0.4mol Cl-离子,ACl2的摩尔质量是,A的相对原子质量是。
胶体是分散质粒子的直径大小在之间的分散系。
100mL、0.5mol/L的(NH4)2SO4溶液中含有NH4+mol,这些NH4+中所含有的电子数为,质子数为。