(15分)CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为:
2NO(g)+2CO(g) N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H= +180.5kJ/mol ①
C(s)+O2(g)=CO2(g) △H= -393.5kJ/mol ②
2C(s)+O2=2CO(g) △H= -221kJ/mol ③
则2NO(g) + 2CO(g) N2(g) + 2CO2(g)△H= 。
N2(g) + 2CO2(g)△H= 。
(2)-定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(NO)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的1/4。
①该反应的平衡常数K= (用只含a、V的式子表示)。
②判断该反应达到平衡的标志是____(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(3)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:
①有害气体NO的转化率是 ,0~15minCO2的平均反应速率v(CO2)=____。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是 (填序号)。
A.增加CO的量 B.加入催化剂
C.降低温度 D.扩大容积体积
(4)通过NOx传感器可监测NOx的含量,其工作原理如图所示,
则:
①Pt电极上发生的是 反应(填“氧化”或“还原”);
②NiO电极上的电极反应式为 。
将一定量的碳、氢、氧三种元素组成的有机物A的蒸气与3.2 g氧气混合点燃,再将生成的气体依次通过①盛有浓硫酸的洗气瓶;②灼热的氧化铜;③饱和石灰水(设每个装置中的反应物均过量)。经测定①中增重3.60g;②中减轻1.60g;③中增重8.80g。A的蒸气的密度为3.393g/L(折算成标准状况)。又测知A既能与碳酸钠溶液反应放出CO2气体,也能与金属钠反应有气体生成,但分别得到的气体的相同条件下体积不同。
(1)试求该有机物的分子式_______________,并写出可能的结构简式_______________。
(2)工业上用以下流程合成A: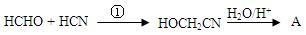
①的反应类型为_____________,画出HOCH2CN的结构式____________________。
(3)写出A在浓硫酸的作用下与醋酸作用,请写出这个方程式:
__________________________________________________________。
(16分) 甲苯是有机化工生产的基本原料之一。利用乙醇和甲苯为原料,可按下列 路线合成分子式均为C9H10O2的有机化工产
路线合成分子式均为C9H10O2的有机化工产 品E和J。
品E和J。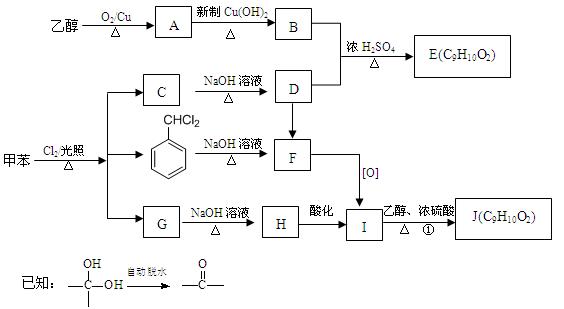
请回答:
(1)写出下列反应方程式
①A→B______________________________________________________。
②G→H ______________________________________________________。
③D→F______________________________________________________。
(2)①的反应类型为__________________;F的结构简式为___________________。
(3)E、J有多种同分异构体,写出符合下列条件的4种同分异构体结构简式。
要求:①与E、J属同类物质②苯环上有两个取代基且苯环上的一氯代物只有两种。
①;②;③;④。
(9分) 现有A、B、C、D、E、F六种化合物,它们分别由下列五种原子团的两种不同的基团组成,这五种基团是-CH3,-C6H5,-OH,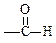 ,
,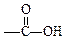 。
。
已知:(1) A是无色晶体,有特殊气味,在空气中易氧化成粉红色;
(2) B、C能发生银镜反应,C的分子量大于B;
(3) D的水溶液与少量氢氧化钠溶液反应,生成-1价的阴离子;与过量氢氧化钠溶液反应,生成-2价阴离子。D可以和A的钠盐反应生成A;
(4) E可以由B氧化制取;
(5) F能氧化成饱和一元醛。
根据上述条件,推断其结构简式分别为:
ABC
DEF。
上述A、D、E的酸性由强到弱的顺序是(用化学式表示)。
(10分) 根据下列合成流程图推断: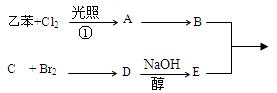
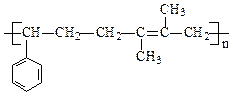
(1)写出下列物质结构简式:
B:C:E:
(2)判断①反应类型:。
(3)写出D→E的反应方程式:。
(11分) 肉桂酸甲酯是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基。已知某一种肉桂酸甲酯的分子结构模型如下图所示(图中球与球之间连线表示单键或双键)。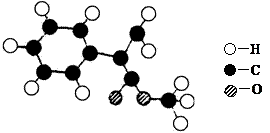
试回答下列问题。
(1)肉桂酸甲酯的结构简式为。
(2)分子中的官能团的名称为_____________________________________。
(3)在苯环上的一氯代物有____________种。
(4)写出该肉桂酸甲酯在氢氧化钠溶液中彻底水解的化学方程式:
______________________________________________________________________。