常温下,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1CH3COOH溶液的滴定曲线如图所示。下列说法正确的是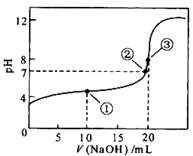
| A.点①所示溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| B.点②所示溶液中:c(Na+)+c(H+)=c(CH3COO-) +c(CH3COOH) +c(OH-) |
| C.点③所示溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
D.在整个滴定过程中:溶液中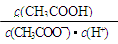 始终不变 始终不变 |
下列叙述正确的是 ( )
| A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.含1 mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应释放热量akJ,则表示该反应中和热的热化学反应方程式为:OH-(aq)+H+(aq)=H2O(l)H = -a kJ·mol-1 |
| C.电解精炼铜时,同一时间内阳极溶解铜的质量可能比阴极析出铜的质量小 |
D.对于2HI(g) H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。 H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。 |
如下图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O
下列说法正确的是( )
| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B.甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=CO32-+8H+ |
| C.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体 |
| D.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
1 L某混合溶液中,溶质X、Y浓度都为0.1mol·L—1,向混合溶液中滴加0.1 mol·L—1某溶液Z,所得沉淀的物质的量如图所示,则X、Y、Z分别是( )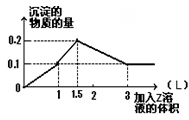
| A.氯化铝、氯化镁、氢氧化钠 | B.偏铝酸钠、氢氧化钡、硫酸 |
| C.氯化铝、氯化铁、氢氧化钠 | D.偏铝酸钠、氯化钡、硫酸 |
在含有n克HNO3的稀溶液中,恰好将5.6克铁粉完全溶解,若有n/4克HNO3被还原成NO(无其它还原产物),则n值不可能是()
| A.12.6克 | B.16.8克 | C.18.9克 | D.25.2克 |
下列说法正确的是()
| A.HF、HCl、HBr、HI的热稳定性依次减弱,沸点却依次升高 |
| B.熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物 |
| C.NCl3分子中所有的原子均为8电子稳定结构 |
| D.NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏的是离子键和共价键 |