硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。生产硫化钠大多采用无水芒硝(Na2SO4)—炭粉还原法,其流程示意图如下: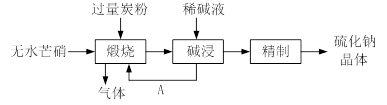
(1)若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生的总的化学反应方程式为 。
(2)上述流程中采用稀碱液比用热水更好,理由是 。
(3)常温下,取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌。若反应后测得溶液的pH=4,则此时溶液中c( S2-)= mol·L-1。
(已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20)
(4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图所示)。为使除汞效果最佳,应控制的条件是:x= ,pH控制在 范围。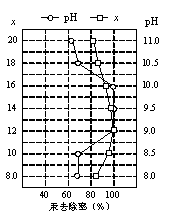
②某毛纺厂废水中含0.001 mol·L-1的硫化钠,与纸张漂白后的废水(含0.002 mol·L-1 NaClO)按1:2的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有 。
(5)常温下利用Fe2+、Fe3+的相互转化,可将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 。
阅读、分析下列两个材料:
材料一、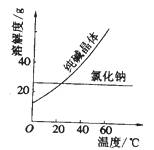
材料二、
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
溶解性 |
| 乙二醇( C2H6O2) |
-11.5 |
198 |
1.11 |
易溶于水和乙醇 |
| 丙三醇(C3H8O3) |
17.9 |
290 |
1.26 |
能跟水、酒精以任意比互溶 |
回答下列问题(填写序号):
| A.蒸馏法 | B.萃取法 | C.“溶解、结晶、过滤”的方法 | D.分液法 |
(1)将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用__________。
(2)将乙二醇和丙三醇相互分离的最佳方法是__________。
填写下表:
| 粒子符号 |
质子数Z |
中子数N |
核外电子数 |
质量数A |
| Cl |
17 |
20 |
||
| S2- |
18 |
32 |
||
| Al3+ |
14 |
27 |
||
| AYm- |
y |
A |
||
| AXn+ |
x |
A |
摩尔这个单位是以________Kg12C中所含的原子数目为标准,来衡量其它粒子集体中所含粒子数目的多少。该数目的数值是个常数,被称为____________________。
现有X、Y、Z三种元素,已知有如下情况:
①X、Y、Z的单质在常温下均为气体。
② X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色。
③ XZ极易溶于水,在水溶液中电离出X+和Z-。XZ的水溶液可使石蕊试液变红。
④两分子X的单质可与一分子Y的单质化合生成两分子X2Y,X2Y常温下为液体。
⑤ Z的单质溶于X2Y中,所得溶液具有漂白作用。
请完成下列问题:
(1)写出XZ和X2Y的化学式:XZ X2Y
(2)Z的单质溶于X2Y后,溶液起漂白作用的物质是 (写化学式)。
(3)写出X的单质在Z的单质中燃烧的化学方程式 。
(4)Z的单质能否与氢氧化钠溶液发生反应: (填“能”或“否”),若能,请写出反应的化学方程式: 。
(若不能反应,则此空不必填写)。
根据反应(1)2P+5Br2+8H2O=2H3PO4+10HBr
(2)Cl2+2HBr=2HCl+Br2
(3)2KMn04+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
推断氧化性(氧化剂)由强到弱的顺序是。
还原性(还原剂)由强到弱的顺序是。