Ⅰ、工业上用含有Cr2O72-和CrO42-的废水回收铬。其工艺流程如下:
已知:①2 CrO42-(黄色)+2H+  Cr2O72-(橙色)+ H2O;
Cr2O72-(橙色)+ H2O;
②常温下,Ksp【Fe(OH)3】=1.0×10-38,Ksp【Cr(OH)3】=1.0×10-32;
③当离子浓度小于1.0×10-5mol·L-1时,认为沉淀完全。
(1)下列选项中能说明反应2 CrO42-(黄色)+2H+  Cr2O72-(橙色)+ H2O达平衡状态的是_______(填选项字母)。
Cr2O72-(橙色)+ H2O达平衡状态的是_______(填选项字母)。
| A.Cr2O72-和CrO42-的浓度相同 |
| B.2v(Cr2O72-)= v(CrO42-) |
| C.溶液的颜色不变 |
| D.溶液的PH不变 |
(2)为防止FeSO4溶液变质,在保存时需加入的试剂为 (填试剂名称)
(3)过滤操作中需要用到的玻璃仪器有
(4)FeSO4溶液与溶液A发生反应的离子方程式为
(5)沉淀C的化学式为 ,pH2的范围为
Ⅱ、铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。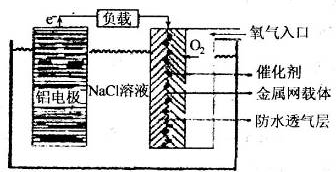
(6)该电池的总反应化学方程式为 ;
(7)某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为 。
水滑石(MgaAlb(OH)c(CO3)d·xH2O)用作阻燃剂及催化剂的载体
(1)MgaAlb(OH)c(CO3)d·xH2O中a、b、c、d的代数关系式为。
(2)为确定水滑石的组成,进行如下实验:取水滑石样品60.2g进行加热时,温度与剩余固体质量的关系如图。认真分析图中曲线变化情况回答下列问题(已知样品在400℃时已完全失水)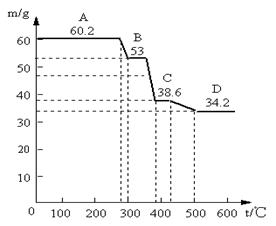
①当温度在0~280℃质量不变,是什么原因:。C→D减少的物质其物质的量为
②该水滑石的化学式为(写出计算过程)
某铝土矿中主要含有Al2O3、Al(OH)3、AlO(OH),还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如下图所示: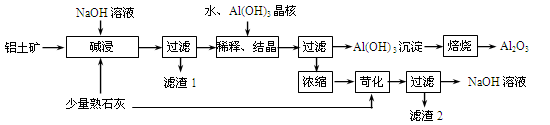
(1)碱浸时为提高铝土矿的浸出率可采取的措施是,。(答两点)
(2)AlO(OH)与NaOH反应的化学方程式为。
(3)在稀释、结晶过程中,加Al(OH)3晶核的目的是促进Al(OH)3的析出。上述“稀释、结晶”工艺,也可用通入足量的某气体的方法来代替。通入气体时发生反应的离子方程式是.
(4)浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化反应除去,写出苛化反应的化学方程式:。
(5)该生产流程能实现(填化学式)的循环利用。
(6)氧化铝是工业上冶炼铝的原料,用氧化铝电解制备金属铝时需加入冰晶石(Na3AlF6)作助熔剂,写出用NaF和Al2(SO4)3反应制备冰晶石的化学方程式为 。
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为______________________________。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为2L 2mol/LKOH溶液),通过装置Ⅱ制备稀H2SO4。若持续通入甲烷,在标准状况下,消耗甲烷的体积V L。
①0<V≤44.8时,装置Ⅰ的总反应方程式为:。
②44.8<V≤89.6时,装置Ⅰ中负极电极反应为:。
③装置Ⅱ中C棒上的电极反应式为:。
④ 若装置Ⅰ中消耗的甲烷在标况下的体积为22.4L,则装置Ⅱ中理论上生成的H2SO4的物质的量为mol。
计算多元弱酸(HnX)溶液的c(H+)及比较弱酸的相对强弱时,通常只考虑第一步电离。回答下列关于多元弱酸HnX的问题。
(1)若要使HnX溶液中c(H+)/c(HnX)增大,可以采取的措施是。
A.升高温度B.加少量固态HnXC.加少量NaOH溶液D.加水
(2)用离子方程式解释NanX呈碱性的原因:。
(3)若HnX为H2C2O4,且某温度下,H2C2O4的K1=5×10-2、K2=5×10-5.则该温度下,0.2mol/L H2C2O4溶液 中c(H+)约为mol/L。(已知
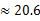 )
)
(4)已知KHC2O4溶液呈酸性。
①KHC2O4溶液中,各离子浓度由大到小的顺序是 。
②在KHC2O4溶液中,各粒子浓度关系正确的是。
A.c(C2O42-)<c(H2C2O4)
B.c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C.c(K+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-)
D.c(K+)= c(C2O42-)+ c(HC2O4-)+ c(H2C2O4)
某温度下,Kw=1×10-13。该温度下,将pH= a,体积为Vx的H2SO4与pH=b,体积为Vy的NaOH混合。
(1)若混合后溶液呈中性。①如果Vx =Vy,则a+b = ,②若a+b = 11,则Vx:Vy=。
(2)若混合后溶液的pH=3,且a=2、b=10,则Vx:Vy=。
(3)将pH= a,体积为Vx的CH3COOH和H2SO4分别加m mL和n mL水稀释,稀释后的pH均为a+2,则mn。(填“>”、“<”或“=”)