1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL (标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀,下列说法不正确的是
| A.该合金中铜与镁的物质的量之比是2∶1 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
根据相关的化学原理,下列判断正确的是()
| A.由于水中存在氢键,所以稳定性:H2O>H2S |
| B.由于二氧化硅的相对分子质量比二氧化碳的大,所以沸点:SiO2>CO2 |
| C.若A2+2D-=2A-+D2,则氧化性:D2>A2 |
| D.若R2-和M+的电子层结构相同,则离子半径:R2->M+ |
下列说法正确的是()
| A.HF、HCl、HBr、HI的热稳定性依次减弱与它们的分子间作用力有关 |
| B.漂白粉、氢氧化铁胶体、盐酸、水玻璃、水泥都是混合物 |
| C.pH相等的CH3COOH、HCl和H2SO4三种溶液和等体积等物质的量浓度的NaOH反应恰好反应,消耗三种酸的体积:c(CH3COOH)<c(HCl)<c(H2SO4) |
| D.向0.1mol·L-1氯化铵溶液中加入水,氯化铵的水解程度增大,溶液酸性增强. |
右图是制取和收集某气体的实验装置,该装置可用于()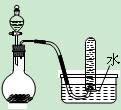
| A.用浓盐酸和二氧化锰反应制取Cl2 |
| B.用二氧化锰固体和过氧化氢反应制取O2 |
| C.用浓硝酸与铜反应制取NO2 |
| D.用浓氨水和生石灰反应制取NH3 |
离子检验的常用方法有三种:
| 检验方法 |
沉淀法 |
显色法 |
气体法 |
| 含义 |
反应中有沉淀产生或溶解 |
反应中有颜色变化 |
反应中有气体产生 |
下列离子检验的方法不合理的是()
| A.NH4+-气体法 | B.Cl--沉淀法 | C.Fe3+-显色法 | D.K+-气体法 |
工业上获得有关物质的方法或途径正确的是()
| A.将氯气通入澄清石灰水,获得漂白粉 |
B.工业上,用SiO2+2C Si+2CO↑制得粗硅 Si+2CO↑制得粗硅 |
| C.钠可把钛、锆、铌、钽等金属从它们的卤化物溶液里还原出来 |
| D.工业上将二氧化硫通入过氧化氢溶液,获得硫酸 |