铝是第二金属,是地壳中含量最多的金属,用途广泛。
51.将某铝土精矿R(Al2O3、Fe2O3)粉末48.8g加入含1mol NaOH的溶液中,发生的反应为:
Al2O3(s)+2NaOH(aq)+ 2H2O(l)→2NaAl(OH)4(aq)
充分反应后,过滤、洗涤、干燥,得到8.0g固体,则该精矿Al2O3的质量分数为 (精确到0.001)。
往滤液中通入CO2,发生的反应为:2NaAl(OH)4 + CO2→2Al(OH)3↓+Na2CO3+ H2O
若生成0.5 mol Na2CO3,则生成Al(OH)3 mol。
52.有反应Al2O3(s)+ Na2CO3(s)
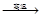 2NaAlO2(s)+ CO2(g)
2NaAlO2(s)+ CO2(g)
2NaAlO2(aq)+ CO2(g) +3H2O→2Al(OH)3↓+Na2CO3
若以铝土精矿R和Na2CO3为原料,除得到Al2O3外,还得到“赤泥”,其成分为(金属元素均以氧化物形式表示):
| |
Al2O3 |
Fe2O3 |
Na2O |
| 质量分数 |
0.065 |
0.850 |
0.029 |
每1t铝土精矿生产时:
得到的赤泥 t(精确到0.001,下同);
可制得Al2O3得 t;
需要补充购买Na2CO3 kg。
53.取a g Al2O3加入溶质的质量分数为b的硫酸溶液中,充分反应后再往溶液加入一定量的(NH4)2SO4,加热、搅拌,冷却后全部溶液正好转化为45.3 g铝铵矾晶体[NH4Al(SO4)2·12H2O,式量:453],则a= ;b= (精确到0.001).
按要求填写:
(1) (系统命名)
(系统命名)
(2)(CH3)2CHCH(CH3)C≡CCH(CH3)2(系统命名)
(3)4,4,5-三甲基-2-己醇(写出结构简式)
(12分)如图所示,组成一种原电池。试回答下列问题(灯泡功率合适):
(1)电解质溶液为稀H2SO4时,灯泡(填“亮”或“不亮”)。若灯泡亮,则Mg为原电池的极;若灯泡不亮,其理由为。
(2)电解质溶液为NaOH溶液时,灯泡(填“亮”或“不亮”)。若灯泡亮,则Al做原电池的极。若灯泡不亮,其理由为。
(3) 铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。
按图取两片质量相当的铝片组装好仪器,接通开关K,通电约25 min。在阳极生成氧化铝,阴极产生气体。写出该过程中的阳极反应式:______________________________。
如果此时取出两极,用蒸馏水洗净,晾干后称重发现两个电极质量差为0.8克,计算阴极产物在标准状态下的体积并写出计算过程。
. 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=,升高温度,K值(填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
| A.氢气的浓度减少 | B.正反应速率加快,逆反应速率也加快 |
| C.甲醇的物质的量增加 | D.重新平衡时n(H2)/n(CH3OH)增大 |
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:(用化学方程式表示)。
(9分)在一定温度下,向一个容积不变的容器中加入3 mol SO2和2 mol O2及固体催化剂,发生反应:2SO2(g)+O2(g)=2SO3(g)ΔH=-196.6 kJ/mol,平衡时容器内气体压强为起始时的90%。
(1)加入3mol SO2和3mol O2发生反应,达到平衡时,SO2的转化率为_____。
(2)保持温度不变,在相同的容器中,将起始物质的物质的量改为a mol SO2、b mol O2、c mol SO3(g)(c>0),欲使平衡时SO3的体积分数为2/9,O2的体积分数为3/9,则:
①达到平衡时,(1)与(2)放出的热量________(填序号)。
| A.相等 | B.前者小于后者 | C.前者大于后者 | D.无法确定 |
②a.b.c必需满足的关系是(一个用a.c表示,另一个用b.c表示):___。
(13分)在100℃时,将0.100 mol 的四氧化二氮气体充入 1 L 恒容真空的密闭容器中,隔一段时间对该容器内的物质浓度进行分析得到下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| c(N2O4)(mol/L) |
0.100 |
c1 |
0.050 |
c3 |
c4 |
| c(NO2)(mol/L) |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
(1)该反应的平衡常数表达式为______________________;
从表中分析:c1________c2;c3________c4(填“>”、“<”或“=”)。
(2)在下图中画出并标明此反应中c(N2O4)和c(NO2)的浓度随时间变化的曲线。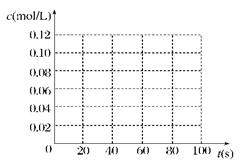
(3)在上述条件下,从反应开始直至达到化学平衡时,四氧化二氮的平均反应速率为__mol/(L·s)。
(4)反应达到平衡后,下列条件的改变可使NO2气体的浓度增大的是
A.增大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He