将过量的CO2分别通入下列溶液中,最终有沉淀析出的溶液是
①CaCl2溶液 ②Na2SiO3溶液 ③Ca(ClO)2溶液 ④饱和Na2CO3溶液.
| A.①②③④ | B.只有①②③ | C.只有②④ | D.只有②③ |
下列物质不能与镁反应的是 ( )
| A.Cl2 | B.N2 | C.CO2 | D.Ar |
下列物质中不含有硅酸盐的是( )
| A.水玻璃 | B.硅芯片 | C.黏土 | D.普通水泥 |
氧化还原反应与四种基本类型反应的关系如右图所示,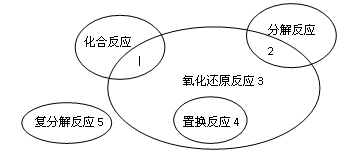
正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是()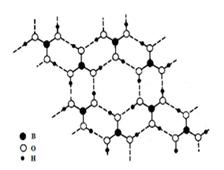
| A.正硼酸晶体属于原子晶体 |
| B.H3BO3分子的稳定性与氢键有关 |
| C.分子中硼原子最外层为8e--稳定结构 |
| D.含1molH3BO3的晶体中有3mol氢键 |
a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为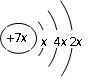 , b与c形成化合物的电子式为
, b与c形成化合物的电子式为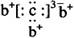 。下列比较中正确的是()
。下列比较中正确的是()
| A.原子半径:a>c>d>b | B.电负性a>b>d>c |
| C.原子序数:d>a>c>b | D.最高价含氧酸的酸性c>d>a |