已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。如下图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下列选项中由实验现象得出的结论完全正确的是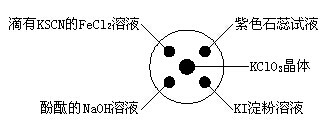
| 实验现象 |
结论 |
| A、滴有KSCN的FeCl2溶液变红色 |
Cl2具有还原性 |
| B、滴有酚酞的NaOH溶液褪色 |
Cl2具有酸性 |
| C、石蕊溶液先变为红色后褪色 |
Cl2具有漂白性 |
| D、KI淀粉溶液中变蓝色 |
Cl2具有氧化性 |
基态碳原子的最外能层的各能级中,电子排布的方式正确的是
A B C D
三氯化磷分子的空间构型是三角锥形而不是平面正三角形,下列关于三氯化磷分子空间构型理由的叙述,不正确的是
| A.PCl3分子中三个共价键的键长,键角都相等 |
| B.PCl3分子中的P-Cl键属于极性共价键 |
C.PCl3分子中三个共价键键能,键角均相 等 等 |
| D.PCl3是非极性分子 |
在 乙烯分子中有5个σ键、一个π键,它们分别是
乙烯分子中有5个σ键、一个π键,它们分别是
| A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 |
| B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键 |
| C.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键 |
| D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键 |
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。 |
| C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。 |
| D.氨气分子是极性分子而甲烷是非极性分子。 |
下列不能形成配位键的组合是
| A.Ag+、NH3 | B.BF3、NH3 | C.Co3+、CO | D.Ag+、H+ |