某科研小组探究工业废Cu粉(杂质含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO4·5H2O,实现废物综合利用,实验过程如下:
过程Ⅰ:
(1)废Cu粉中一定含有的杂质是 (填化学式)
(2)写出过程②发生反应的离子方程式: 。
过程Ⅱ: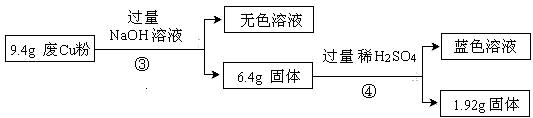
(3)综合过程Ⅰ、II,计算废Cu粉中各成分的质量之比是 (化为最简整数比)
过程Ⅲ:已知25℃时:
| 电解质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 溶度积(Ksp) |
2.2×10-20 |
8.0×10-16 |
4.0×10-38 |
| 开始沉淀时的pH |
5.4 |
6.5 |
3.5 |
| 完全沉淀时的pH |
6.4 |
9.6 |
4.0 |
(4)在Ⅱ中所得蓝色溶液中加入一定量的H2O2溶液,调节溶液的pH范围为 ,然后过滤、结晶,可得CuSO4·5H2O。
(5)下列与 Ⅲ方案 相关的叙述中,正确的是 (填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+ 氧化为Fe3+ 的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH选择的试剂可以是氢氧化铜或氧化铜
D.在pH>4的溶液中Fe3+一定不能大量存在
某化学兴趣小组用铜和浓硫酸制取SO2,并依次检验SO2具有酸性氧化物的性质和还原性、漂白性、氧化性,所用仪器如下图所示(图中连接胶管、夹持和加热装置省略):
查阅资料可知,HSO3- 的酸性强弱与H2CO3相近。请回答下列问题:
(1)装置A中发生反应的化学方程式是:A
(2)上述装置的接口连接顺序依次是a→→→→→g→h→d(填导管接口字母)。
(3)证明SO2具有氧化性的现象是;证明SO2具有还原性的实验中,反应的离子方程式是。
(4)C试管中NaOH溶液的作用是,CCl4的作用是。
下列关于应用套管实验装置(部分装置未画出)进行的实验,叙述错误的
| A.利用甲装置可以制取少量H2 |
| B.利用乙装置可以验证Na2O2与水反应既生成氧气,又放出热量 |
| C.利用丙装置验证KHCO3和K2CO3的热稳定性,X中应放的物质是K2CO3 |
| D.利用丁装置制取SO2,并检验其还原性,小试管中的试剂可为酸性KMnO4溶液 |
(12分)如图为实验室制取和收集纯净干燥的氯气,并进行氯气性质探究的实验装置图:
|
下列是与硫元素相关的一系列实验:根据下图所示实验回答下列问题:
(1)试管C口部的棉团上(碱过量)发生反应的离子方程式是
(2)反应一段时间后,停止反应,将B试管中的溶液加热,可以观察到。试管C中溶液变浑浊,则证明SO2具有性。
(3)试管C口部的棉团既可浸碱溶液,又可浸NaHCO3溶液,其作用是,如果浸NaHCO3溶液(过量),则发生反应的化学方程式是。
(4)如将B试管换成D试管,并从直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是(写两种)
下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、6 mol/L硫酸溶液,其他试剂任选。填写下列空白: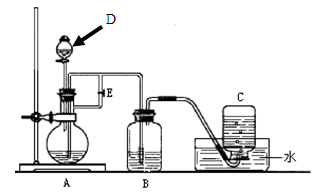
(1)B中盛有一定量的NaOH溶液,D仪器的名称,A中反应的离子方程式为。
(2)实验开始时应先将活塞E(填“打开”或“关闭”), 在C中收到的气体主要为;当C瓶或A瓶中的气泡时,将活塞E(填“打开”或“关闭”),此刻B瓶中可能发生的化学反应(用离子方程式表示,有几个写几个)是:;
(3)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:。