废易拉罐的成分比较复杂,据查,铝易拉罐各部分成分及含量(质量百分含量)见表:
| |
Si |
Fe |
Cu |
Mn |
Mg |
Cr |
Zn |
Ti |
Al |
| 罐身/% |
0.3 |
0.7 |
0.25 |
0.25 |
1.0~1.5 |
|
|
|
其余 |
| 罐盖/% |
0.2 |
0.35 |
0.15 |
0.2~0.5 |
4.0~5.0 |
|
0.1 |
0.25 |
其余 |
| 拉环/% |
0.2 |
0.35 |
0.15 |
0.2~0.5 |
3.0~4.0 |
0.1 |
0.25 |
0.1 |
其余 |
为了验证罐身的组成成分,进行了如下实验:
【实验仪器与药品】
仪器:酒精灯、烧杯、试管、试管夹、漏斗、滤纸、铁圈、玻璃棒、砂纸、剪刀
药品:易拉罐、去污粉、NaOH溶液、KSCN溶液、盐酸、镁试剂、高碘酸(H3IO6,弱酸)
【实验方案】
实验预处理:将剪好的易拉罐片用砂纸打磨,除去表面的涂料层,直到光亮后用去污粉清洗干净备用。
【实验过程】分别向试管a、b中加入少量上述易拉罐片,进行如下操作:
请填写下列空白:
(1)图中操作①②所用到的玻璃仪器有 。
(2)沉淀A的成分为 。
(3)操作③观察到的现象为 ;反应的离子方程式为 、
、 。
(4)若试管a、b中取样相同,则分别加入足量的NaOH溶液、稀盐酸后,相同条件下理论上产生的气体体积V(a) V(b)(填“>”、“<”或“=”)
氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如下图所示的装置。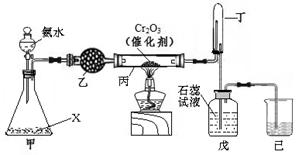
(1)若分液漏斗中氨水的浓度为9.0mol·L-1,配制该浓度的氨水100mL,用到的玻璃仪器有100mL容量瓶、烧杯、玻璃棒、。
(2)甲装置不需要加热即能同时产生氨气和氧气,烧瓶内固体X的名称为。
(3)乙装置的作用是 ;写出受热时丙装置发生反应的化学方程式为。
(4)当戊中观察到现象,则说明已制得硝酸。某同学按上图组装仪器并检验气密性后进行实验,没有观察到此现象,请分析实验失败的可能原因。如何改进装置。
(5)改进后待反应结束,将丁装置倒立在盛水的水槽中,会观察到的现象是;为测定试管丁内硝酸溶液的浓度,从中取10mL溶液于锥形瓶中,用0.1 mol·L-1的NaOH溶液滴定。滴定前发现滴定管尖嘴处有少量气泡,请选择排出气泡的正确操作是。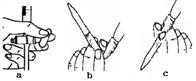
工厂中用稀硫酸浸泡某矿石后的溶液中,除了含有大量硫酸外,还含有少量NH4+、Fe3+、AsO43-、Cl-。为除去杂质离子,部分操作流程如下:
请回答问题:
(1)用稀硫酸浸泡某矿石后的溶液中,硫酸的浓度为4.9g·L-1,则该溶液中的pH约为。
(2)NH4+在用稀硫酸浸泡某矿石后的溶液中以(NH4)2SO4和NH4Cl形式存在。现有一份(NH4)2SO4溶液,一份NH4Cl溶液,(NH4)2SO4溶液中c(NH4+)恰好是NH4Cl溶液中c(NH4+)的2倍,则c[(NH4)2SO4]c(NH4Cl)(填:<、=或>)。
(3)随着向废液中投入生石灰(忽略溶液温度的变化),溶液中 _______(填“增大”、“减小”或“不变”)。
_______(填“增大”、“减小”或“不变”)。
(4)投入生石灰调节pH到2~3时,大量沉淀主要成分为CaSO4·2H2O[含有少量Fe(OH)3],提纯CaSO4·2H2O的主要操作步骤:向沉淀中加入过量,充分反应后,过滤、洗涤、。
(5)25℃, H3AsO4电离常数为K1=5.6×10-3,K2=1.7×10-7,K3=4.0×10-12。当溶液中pH调节到8~9时,沉淀主要成分为Ca3(AsO4)2。
①pH调节到8左右Ca3(AsO4)2才开始沉淀的原因是。
②Na3AsO4第一步水解的平衡常数数值为:。
③已知:AsO43-+2I-+2H+= AsO33-+I2+H2O ,SO2+I2+2H2O=SO42-+2I-+4H+ 。上述两个反应中还原性最强的微粒是。
硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。它易溶于水,难溶于乙醇,加热、遇酸均易分解。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图: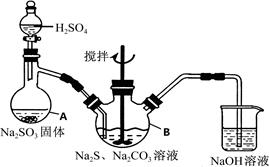
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O3·5H2O。
④再经过滤、洗涤、干燥,得到所需的产品。
(1)写出仪器A的名称步骤④中洗涤时,为了减少产物的损失用的试剂可以是。
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH<7,请用离子方程式解释原因。
(3)写出三颈烧瓶B中制取Na2S2O3反应的总化学反应方程式。
(4)最后得到的产品中可能含有Na2SO4杂质。请设计实验检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:。
(5)测定产品纯度
准确称取1.00 g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为2S2O32-+I2===S4O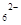 +2I-。滴定起始和终点的液面位置如图:则消耗碘的标准溶液体积为_______mL。产品的纯度为%。
+2I-。滴定起始和终点的液面位置如图:则消耗碘的标准溶液体积为_______mL。产品的纯度为%。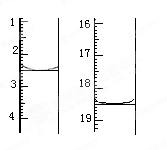
(6)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为__________________。
(13分)重铬酸钾是一种重要的氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3、SiO2、Al2O3)为原料生产。实验室模拟工业法用铬铁矿制重铬酸钾(K2Cr2O7)的主要工艺如下: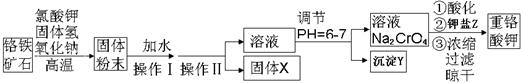
试回答下列问题:
(1)以上工艺流程所涉及元素中属于过渡元素的有。铁在周期表的位置是。
(2)操作Ⅱ的名称是。
(3)固体X的主要成分是___________,沉淀Y的主要成分是。
(4)流程中①酸化所用的酸和②钾盐Z最合适的是(填符号)________,
| A.盐酸和氯化钾 | B.硫酸和氯化钾 |
| C.硫酸和硫酸钾 | D.次氯酸和次氯酸钾 |
酸化反应的离子方程式为。
(5)FeO·Cr2O3与氯酸钾、氢氧化钠高温反应化学方程式:。
(14分)某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此实验小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。
已知:常温下,CO能使一些化合物中的金属离子还原。例如:PdCl2+CO+H2O=Pd↓+CO2+2HCl,反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。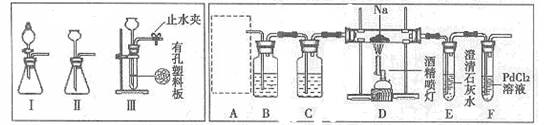
请回答下列问题:
(1)为了使制气装置能“随开随用,随关随停”,上图A处制取CO2气体应选用的装置是(填写“I”、“II”或“III”),其离子方程式是。装置B和C中应盛放的试剂分别是,。
(2)观察实验装置图可知Na与CO2反应的条件是,检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是,这步操作的目的是。
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:
①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是。
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是。
(4)请判断②中D装置生成固体的成分是钠的(填“正盐”或“酸式盐”)。请用文字简要说明理由。