一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下: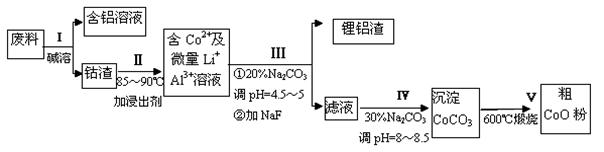
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的离子反应方程式为(产物中只有一种酸根) 。请从反应原理分析不用盐酸浸出钴的主要原因____________________________________。
(3)碳酸钠溶液在过程III和IV中所起作用有所不同,请分别用离子方程式表示在过程III、IV中起的作用:__________________________;___________________________。
A~G都是有机化合物,它们的转化关系如下:
请回答下列问题:
(1)已知:6.0g化合物E完全燃烧生成8.8gCO2和3.6gH2O;E的蒸气与氢气的相对密度为30,则E的分子式为_______________:
(2)A为一取代芳烃,B中含有一个甲基。由B生成C的化学方程式;
(3)由B生成D、由C生成D的反应条件分别是_______________、_____________;
(4)由A生成B、由D生成G的反应类型分别是_______________、_____________;
(5)F存在于栀子香油中,其结构简式为_______________;
(6)在G的同分异构体中,苯环上一硝化的产物只有一种的共有________个,分子中有两种不同化学环境的氢原子且两种氢原子数目相等的是(填结构简式)。
从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:
(1) 甲中除苯环外,官能团的名称为。
(2) 由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
则Ⅰ的反应类型为,Ⅱ的化学方程式为(注明反应条件)。
(3)已知:
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):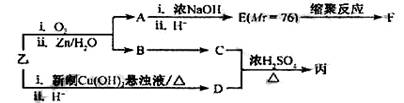
①下列物质不能与C反应的是(选填序号)
a.金属钠 b.HBr c.Na2CO3溶液 d.乙酸
②写出F的结构简式。
③D有多种同分异构体,任写其中一种能同时满足下列条件的异构体结构简式
。
a.苯环上连接着三种不同官能团 b.能发生银镜反应
c.能与Br2/CCl4发生加成反应 d.遇FeCl3溶液显示特征颜色
④综上分析,丙的结构简式为。
T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示,3分钟时达到平衡;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。
(1)容器中发生的反应可表示为________________________
(2)反应进行的前3 min内,用X表示的反应速率 v(X)=____________mol/(L·min)
(3)保持其他条件不变,升高温度,该反应的化学平衡将向________方向移动(填“正反应”或“逆反应”)
(4)①若改变反应条件,使反应进程如图3所示,则改变的条件是____________
②一定条件下的密闭容器中,该反应达到平衡,要提高气体Y的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少Z的浓度 d.增加气体Y的浓度
已知常温常压下:① 3Cl2+2NH3→N2+6HCl,②3Cl2+8NH3→N2+6NH4Cl
(1)完成并配平反应③的化学方程式,并标出电子转移方向和数目:
③ 3Cl2+4NH3→
(2)在反应③中:还原剂是,还原产物是。
(3)若按③反应后产生气体4.48 L(标准状况),则被氧化的气体的物质的量是mol。
(1)原子核内无中子的元素可放在元素周期表的族,又根据最高正化合价和负化合价的绝对值相等可放在族,该元素还可放在元素周期表的族。它的核外电子排布式为,它和氧元素可形成的化合物的电子式为。
(2)科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”。

A B
则A、B两幅图中能表示“热冰”的示意图为。使水结成“热冰”采用“弱电场”的条件,说明水分子是分子。(选填“极性”或“非极性”)
(3)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子(H2O+)。这种阳离子具有较强的氧化性,试写出该离子与H2S的水溶液反应的离子方程式;该反应破坏的化学键是。