实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如右图所示: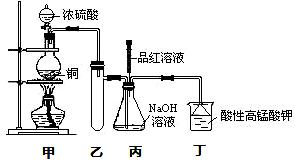
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,则H2SO4是否有剩余________(填“是”或“否”),原因是_______________。
(2)装置乙的作用是_____________________________________________。
(3)装置丁的作用是吸收污染空气的SO2气体,其反应的离子方程为 。
(4)若将SO2 通入氯水中,化学反应方程式为 。
(5)下列说法正确的是________(填序号)。
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
c.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
d.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
(6)现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2 mol/L盐酸、2 mol/L硝酸、1 mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水。
请设计实验探究吸收后产物中是否存在NaHSO3 和Na2SO3,将实验操作、预期的实验现象和结论填在下表中。
| 实验操作 |
预期现象与结论 |
| 步骤1:取少量待测液放入试管中,滴加过量l mol/L氯化钡溶液。静置一段时间后,得到滤液A和固体B。 |
|
| 步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴品红,再 |
若品红褪色(或有气泡),则 |
| 步骤3: |
若 , 则 ; 否则 。 |
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有 ▲ 中的一种或两种。
【实验探究】
| 实验操作 |
预期现象 |
结论 |
|
| 验证猜想Ⅰ |
步骤①:取少量0.01 mol/L 酸性KMnO4溶液,滴入所得溶液 |
▲ |
▲ |
| 步骤②: ▲ |
▲ |
含有Fe3+ |
|
| 验证猜想Ⅱ |
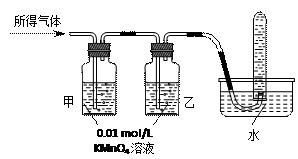
将所得气体通入如下装置 |
▲ |
含有两种气体 |
【问题讨论】
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,请对该观点进行评价: ▲ 。
(福建师大附中2008-2009学年高三第一学期第一学段检测,化学,22)(1)用5.0mol/L的NaOH溶液配制2.0mol/L的NaOH溶液时,下图所示的仪器中,肯定不需要的是 (填序号),配制上述溶液还需要的玻璃仪器是 (填仪器名称)。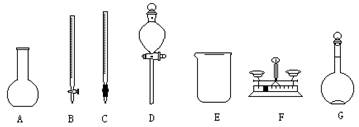
(2)在配制过程中,下列操作将导致实际所配NaOH溶液浓度偏低的是(填编号) _ _。
①准确取出的浓NaOH溶液在空气中露置时间过长;②用量器将浓NaOH溶液直接加入容量瓶,缓慢加入蒸馏水至液面最低点恰好和环形刻度线相切;③摇匀后,液面低于刻度线,再加蒸馏水至液面最低点恰好和环形刻度线相切;④用于稀释NaOH溶液的仪器未洗涤。
(安徽省芜湖市一中2008届高三第二次模拟考试,化学,16)下面a~e是中学化学实验中常见的几种定量仪器:
(a)量筒(b)容量瓶(c)滴定管(d)托盘天平(e)温度计
(1)其中标示出仪器使用温度的是(填写编号)
(2)由于操作错误,使得到的数据比正确数据偏小的是(填写编号)
A.实验室制乙烯测量混合液温度时,温度计的水银球与烧瓶底部接触
B.中和滴定达终点时俯视滴定管内液面读数
C.使用容量瓶配制溶液时,俯视液面定容所得溶液的浓度
(3)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为g。
Ⅰ.化学实验室制取氯化氢气体的方法之一是将浓硫酸滴入浓盐酸中。请从下图中挑选所需仪器,在方框内画出用该方法制备、收集干燥氯化氢气体的装置简图,并在图中标明所用试剂。(仪器可重复使用,固定装置不必画出)。
Ⅱ.实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%-30%的稀硫酸溶液,在50℃-80℃水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集产品。
(1)写出该实验制备硫酸亚铁的化学方程式:。
(2)硫酸溶液过稀会导致。
(3)采用水浴加热的原因是。
(4)反应时铁屑过量的目的是(用离子方程式表示)。
(5)溶液趁热过滤的原因是塞紧试管口的目的是
(6)静置冷却一段时间后,在试管中观察到的现象是。
如图学习小组甲、乙所示进行乙醇的催化氧化实验,试管A中盛有无水乙醇,B中装有Cu或CuO(用石棉绒作载体),C中装的是蒸馏水。请回答下列问题: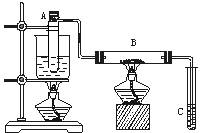

甲乙
⑴甲中B内放置的是; 乙中B内放置的是。
乙向试管A中鼓入空气的目的是_____________________。
⑵甲乙装置中A试管为什么都要水域加热:。
⑶甲中玻璃管中可观察到的现象是_____________________;
甲和乙中反应的化学方程式分别是_______________________;
。
⑷在实验过程中试管C导管口有气泡冒出,从液面逸出的气体的主要成分是_______________________。