设NA为阿伏加德罗常数的值。下列说法正确的是
| A.0.1mol/L NH4+ 中含有质子数为NA |
| B.26g 乙炔中含有π键数为2NA |
| C.标准状况下,22.4LSO3中所含分子数为NA |
| D.1 L0.1mol·L-1NaHCO3溶液中所含氧原子数为0.3NA |
室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
| 加入的物质 |
结论 |
|
| A |
50mL 1 mol·L-1H2SO4 |
反应结束后,c(Na+)=c(SO42-) |
| B |
0.05molCaO |
溶液中 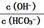 增大 增大 |
| C |
50mL H2O |
由水电离出的c(H+)·c(OH—)不变 |
| D |
0.1mol NaHSO4固体 |
反应完全后,溶液pH减小,c(Na+)不变 |
一定温度下,在三个体积均为1.0 L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
| 容器编号 |
温度(℃) |
起始物质的量(mol) |
平衡物质的量(mol) |
|
| CH3OH(g) |
CH3OCH3(g) |
H2O(g) |
||
| Ⅰ |
387 |
0.20 |
0.080 |
0.080 |
| Ⅱ |
387 |
0.40 |
||
| Ⅲ |
207 |
0.20 |
0.090 |
0.090 |
下列说法正确的是
A.该反应的逆反应为放热反应
B.达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小
C.达到平衡时,容器Ⅰ中的压强与容器Ⅲ中的压强相同
D.若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH3 0.15 mol 和H2O 0.10 mol,则反应将向正反应方向进行
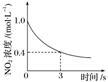
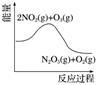
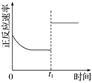
臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g) N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
| A |
B |
C |
D |
 |
 |
 |
 |
| 0~3s内,反应速率v(O3)=0.2mol·L-1·s-1 |
降低温度,平衡常数增大 |
t1时仅加入催化剂,平衡正向移动 |
达平衡时,仅改变x,则x为c(O2) |
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
A.反应CH4+H2O 3H2+CO,每消耗1molCH4转移12mol 电子 3H2+CO,每消耗1molCH4转移12mol 电子 |
| B.电池工作时,CO32-向电极B移动 |
| C.电极B上发生的电极反应为O2+2CO2+4e-=2CO32- |
| D.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O |
下图是元素周期表中短周期的一部分。已知A、B两元素原子的最外层电子数之和等于E元素原子的最外层电子数。下列有关说法正确的是
A.元素B和E、B和D形成的化合物在固态时都属于分子晶体
B.工业上可用A、D形成的化合物制取A的单质;B的单质在信息工业有广泛用途
C.与E同族的元素中,若简单阴离子的还原性越强,则该元素的最高价氧化物对应水化物的酸性也越强
D.元素B的简单氢化物分子的空间构型为正四面体,元素C的简单氢化物的沸点比元素D的简单氢化物的沸点高