NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.1molFeCl3跟沸水反应转化成氢氧化铁胶体后,生成胶体微粒的数目为NA |
| B.电解精炼铜时,若转移了NA个电子,则阴极析出32 g铜 |
| C.6.8克熔融的KHSO4中含有0.1NA个阳离子 |
| D.标准状况下,11.2L四氯化碳所含分子数为0.5NA |
下述实验能达到预期目的的是()
| 实验内容 |
实验目的 |
|
| A |
将1 mL KSCN溶液与1 mL 同浓度 FeCl3溶液充分混合;再继续加入KSCN溶液,溶液颜色加深 |
证明溶液中存在平衡: Fe3+ + 3SCN-  Fe(SCN)3 Fe(SCN)3 |
| B |
在滴有酚酞的Na2CO3溶液中,加入BaC12溶液 后红色褪去 |
证明Na2CO3溶液中存在水解平衡 |
| C |
向1mL0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L的 MgCl2溶液产生白色沉淀后,再滴加2滴0.1 mol/L的FeCl3溶液,又生成红棕色沉淀 |
证明在相同温度下,氢氧化镁的溶解度大于氢氧化铁的溶解度 |
| D |
测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 |
证明非金属性S>C |
已知某温度下,在2L密闭容器中加入一定量A,发生以下化学反应:2A(g) 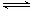 B(g) + C(g);ΔH = −48.25 kJ/L
B(g) + C(g);ΔH = −48.25 kJ/L
时间t与A 、B的浓度有下图所示关系,若测得第15min时c(B)=1.6 mol/L,则下列结论正确的是()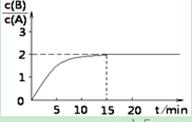
A.该温度下此反应平衡常数为3.2
B.A的初始物质的量为4 mol
C.0-15min内,气体密度不变
D.要使c(B)/c(A)= 3,只能降低反应温度
能正确表示下列反应的离子反应方程式为()
| A.明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+ |
| B.NH4HCO3溶于过量的浓KOH溶液中: NH4++ HCO3-+2OH-= CO32-+ NH3↑+2 H2O |
| C.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全: 2Al3++3SO42-+3Ba2++6OH -="2" Al(OH)3↓+3BaSO4↓ |
| D.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O |
下图表示2A(g)+B(g) 2C(g) ΔH<0,这个反应的正确图像为()
2C(g) ΔH<0,这个反应的正确图像为()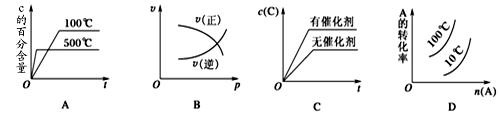
反应:2H2(g)+O2(g)===2H2O(l)过程中的能量变化如图所示,下列有关说法中正确的是()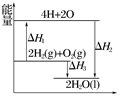
| A.ΔH1<0 | B.ΔH2为该反应的反应热 |
| C.ΔH3不是H2的燃烧热 | D.ΔH2=ΔH1+ΔH3 |