【化学—选修3物质结构与性质】
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族。 E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 。
(2)E2+离子的价层电子排布图是 ,F原子的电子排布式是 。
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,B元素的气态氢化物的VSEPR模型为 。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为 。
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程为 。
(6)某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为 ,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度d= g/cm3。(保留两位小数)
(15分)阅读分析材料,据此完成下列要求
短周期元素A、B、C、D、E、F,它们的原子序数依次增大,其中B和C为同一周期;D、E、F为同一周期;A和D、C和F分别为同一主族;C元素原子的最外层电子数是次外层电子数的3倍;D是所在周期原子半径最大的元素(除稀有气体外);E是非金属元素,其单质在电子工业中有重要用处。
⑴A元素与碳元素按质量比1:3可以形成化合物X,将C2、X和23.4gD2C2置于密闭容器中,用电火花引起化学反应,反应结束后,容器内的气压为零(250℃),将残留物溶于水中,无气体产生,则C2与X的物质的量之比为 。根据其反应方程式分析,若反应中有4mol电子转移,则消耗C2的物质的量为 mol。
⑵工业上生产单质E的化学方程式为: ;指出E的氧化物在通讯中的一种用途 。
⑶一定条件下,A2气体与B2气体充分反应可生成6.8g空间构型三角锥形的气体,放出18.44kJ热量,则该反应的热化学方程式为为: ;A与B按原子个数比1:2可形成相对原子质量为32的化合物,写出该化合物与足量盐酸反应的离子方程式 。
⑷A2与C2在KOH的浓溶液中可以形成原电池。如果以Pt为电极,在电池的两极分别通入A2和C2,则通入的A2一极的电极反应式为: 。
⑸在10L的密闭容器中,通入2molFC2和3molC2气体,一定条件下反应后生成FC3气体,当反应达到平衡时,C2的浓度为0.21mol/L,则平衡时FC2的转化率为 。
有机物W~H有如下的转化关系。已知W、B为芳香族化合物,X为卤素原子,W、A、B均能与NaHCO3溶液反应,A分子中有2个甲基,H分子中含有醛基和苯环且H分子苯环上的一氯取代物只有两种 。请回答下列有关问题:
。请回答下列有关问题: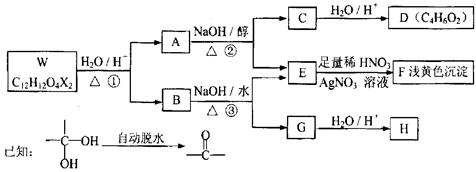
请回答下列有关问题:
(1)反应①、②分别属于反应、反应(填有机反应类型),A、B中均含有的含氧官能团的名称是。
(2)F的化学式,B的结构简式。
(3)反应②的化学方程式是。
(4)若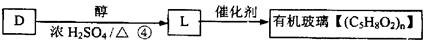
反应④的化学方程式是。
(5)H有多种同分异构体,写出任意一种同时满足(i)遇FeCl3显紫色(ii)苯环上—取代物有两种(iii)除苯环外无其它环状结构3个条件的H的同分异构体结构简式。
下图所示各物质是由1~20号元素中部分元素组成的单质或化合物,图中部分反应条件未列出。已知D、L、M为气体单质,C、E、H为气体化合物,反应②、④、⑥是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。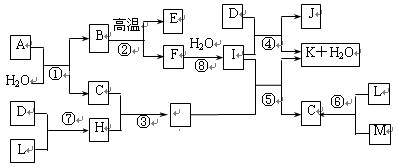
请回答下列问题:
(1)物质E的结构式为 __________。
(2)属于化合反应,但不属于氧化还原反应的是__________(用编号填空)。
(3)C、H的熔沸点比较:C___H(填““>”、“<”或“=”))原因是:________________。
(4)物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A的化学式为
______________。
(5)在一定温度下,有甲、乙 两容积相等的密闭容器。
两容积相等的密闭容器。
I.向甲容器中通入3 mol M和4 mol L,反应达到平衡时,生成C的物质的量为a mol。此时,M的转化率为__________。下列能提高反应物L的转化率,但实际生产过程中并没有采用的措施是_____________。
①降低合成塔温度②适当增大压强
③不断分离出产物C④加入合适催化剂
II.向乙中通入2 mol C,欲使反应达到平衡时,各物质的浓度与I中第一次平衡时相同,则起始时还需通入__________mol M和__________mol L。
III.若起始时,向乙中通入6mol M和8mol L,达到平衡时,生成C的物质的量为b mol,
则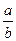 ________
________ 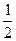 (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。
(1)环境专家认为可以用金属铝将水体中的NO-3转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH-、Al(OH)3、NO-3、N2,请将各粒子分别填入以下空格内(不用配平)。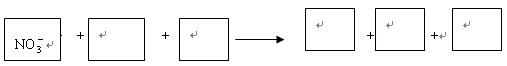
该反应过程中,被氧化与被还原的元素的物质的量之比为。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3。电池正极的电极反应式为;正极材料采用了铂网,利用铂网为正极的优点是。
(3)若:4Al(s)+3O2(g)=2Al2O3(g)△H=" a" kJ/mol
Fe2O3(s)+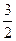 C(s)=
C(s)= 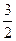 CO2(g)+2Fe(s)△H=" b" 1kJ/mol
CO2(g)+2Fe(s)△H=" b" 1kJ/mol
C(s)+O2(g)=CO2(g)△H=" c" kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式。
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20ml,pH=14的溶液,然后用2mol/L盐酸滴定 ,可得沉淀质量与消耗的盐酸体积关系如右图:
,可得沉淀质量与消耗的盐酸体积关系如右图: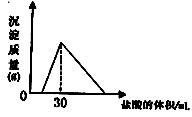
则反应过程中产生氢气的总体积为L(标准状况)。
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应: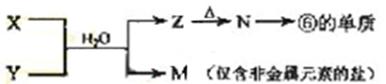
X溶液与Y溶液反应的离子方程式为_____________________,
N→⑥的单质的化学方程式为________________。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。