常温下,下列有关物质的量浓度关系正确的是
| A.等物质的量浓度的溶液中,水电离出的c(H+):HCl>CH3COOH |
| B.pH相同的溶液中:c(Na2CO3)<c(NaHCO3) |
| C.在Na2SO3溶液中:c(Na+) = 2c(SO32— ) + c(HSO3— ) + c(OH— ) |
| D.0.1mol·L—1NaHS溶液中:c(Na+) = c(HS-) |
短周期元素X、T、Y、Z、R原子序数依次增大,T最内层电子数为最外层的2倍,部分元素的化合价关系如下表。则下列判断正确的是
| X |
Y |
Z |
R |
|
| 主要化合价 |
-4,+4 |
-4,+4 |
-2,+6 |
-1,+7 |
A.非金属性:Z < R < Y
B.T与R可以形成化合物: TR2
C.X与R的单质均能使品红溶液褪色
D.T的最高价氧化物的水化物能与X、Y、Z的最高价氧化物反应
常温下,各1L的 0.1 mol·L-1的HX溶液与0.1 mol·L-1某一元碱ROH溶液加水稀释,两溶液pH与加水体积变化曲线如图,下列说法正确的是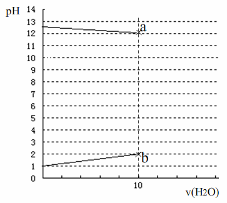
| A.HX为一种弱酸,ROH为弱碱 |
| B.a、b两点由水电离出c(H+)均为10-12mol·L-1 |
| C.两溶液等体积混合: c(X-) = c(R+)+ c(ROH) |
| D.两溶液等体积混合:c(R+)>c(X-)>c(OH-) >c(H+) |
下列实验操作能达到预期实验目的的是
| 选项 |
目的 |
操作 |
| A |
检验Fe2(SO4)3溶液中是否含有FeSO4 |
取少量溶液于试管, 加入几滴0.1 mol/L KMnO4溶液 |
| B |
证明Al(OH)3是两性氢氧化物 |
取Al(OH)3于试管A、B,分别滴加氨水与盐酸 |
| C |
比较S与P元素非金属性强弱 |
测定等浓度H2SO3、H3PO4的pH |
| D |
除去Na2CO3中的NaCl |
溶解,加入AgNO3溶液至不再产生沉淀,静置,过滤 |
某小组进行电化学研究,甲同学设计如下图的装置图,乙同学利用甲的装置和桌面其他的药品与材料,不能完成的实验是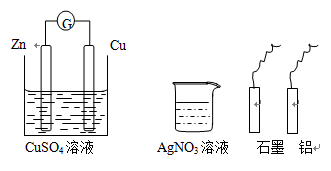
| A.使甲同学的正极变为负极 |
| B.设计一个新的原电池 |
| C.在碳电极上镀锌 |
| D.使锌电极受到保护 |
设nA为阿伏加德罗常数的数值,下列说法正确的是
A.常温下,78g的苯含有3nA个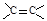 双键 双键 |
| B.1L 0.1 mol·L-1的NH4Cl溶液中有0.1nA个NH4+ |
| C.标准状况下,22.4 L SO2与CO2混合物含有2nA个O原子 |
| D.常温下,5.6 g铁块投入足量浓硝酸中失去0.3nA个电子 |