某小组进行铝热反应实验,装置如图所示。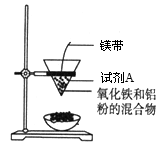
(1)铝热反应原理 (写化学方程式),试剂A为 (写化学式)。
(2)对坩埚内的黑色固体物质的组成,小组进行了如下探究
假设I:该黑色物质为铁
假设Ⅱ:该黑色物质为铁与氧化铁的混合物
【设计方案并实验】
| 实 验 步 骤 |
现 象 |
结 论 |
| ①取少量黑色固体于试管中加稀盐酸 |
固体全部溶解,有气泡产生 |
假设I成立,假设Ⅱ不成立 |
| ②滴入几滴0.01mol/LKSCN溶液 |
溶液不变色 |
【交流评价】
你认为上述结论是否合理? ,理由是 。
(3)取上述实验所得溶液,滴入适量氯水溶液变红色。
①此时涉及的氧化还原反应的离子反应方程式为 。
②利用反应体系中存在的平衡:Fe3++3SCN— Fe(SCN)3,小组再将滴入适量氯水的溶液平均分成两份,分别置于两支试管中并编号l、2,进行如下表所示的探究。该实验中,小组主要探究的问题是 ;应重点观察的现象是 ;预计得出的结论是 。
Fe(SCN)3,小组再将滴入适量氯水的溶液平均分成两份,分别置于两支试管中并编号l、2,进行如下表所示的探究。该实验中,小组主要探究的问题是 ;应重点观察的现象是 ;预计得出的结论是 。
| 实验编号 |
实验步骤 |
| 1 |
①滴加饱和FeCl3溶液4滴,充分振荡 |
| ②滴加几滴NaOH溶液 |
|
| 2 |
①滴加4滴1mol/LKSCN溶液 |
| ②滴加几滴NaOH溶液 |
下列操作中正确的是
| A.用蒸发方法使NaCl从溶液中析出时,将蒸发皿中NaCl 溶液全部加热蒸干 |
| B.在托盘天平上称量NaOH时,应将NaOH固体放在小烧杯中称量 |
| C.用25 mL量筒量取4.0 mol/L的盐酸5.62 mL |
| D.用托盘天平准确称取5.85 g NaCl固体 |
已知氧化性Fe3+>Cu2+。现将铜粉放入稀盐酸中,微热后无明显现象发生;当加入下列物质后,铜粉的质量减少。则加入的物质不可能是
| A.FeSO4 | B.Fe2(SO4)3 | C.KNO3 | D.HNO3 |
关于某溶液中所含离子的检验,下列判断正确的是
| A.加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不消失,则原溶液中一定含有SO42- |
| B.向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中滴几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ |
| C.用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色的火焰,则原溶液中一定不含有K+ |
| D.加盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32- |
物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积比为3∶2∶1时,三种溶液中Cl—的物质的量之比为
| A.1∶1∶1 | B.1∶2∶3 | C.3∶2∶1 | D.3∶4∶3 |
设NA表示阿伏加德罗常数,下列叙述中正确的是
| A.标准状况下,2.24 L CCl4所含的原子数为0.5 NA |
| B.100 mL 0.1 mol/L的NaCl溶液中,所含微粒总数为0.02 NA |
| C.1.7 g的OH-中含有的电子数为NA |
| D.78 g Na2O2与足量水反应转移电子数为2 NA |