海波(Na2S2O3·5H2O)常用手纺织和造纸工业,海波是无色透明的晶体,易溶于水,遇酸立即分解:S2O32— + 2H+=S↓+ SO2↑+ H2O。硫化碱法是工业上制备海波的方法之一,反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O,实验装置如下图所示: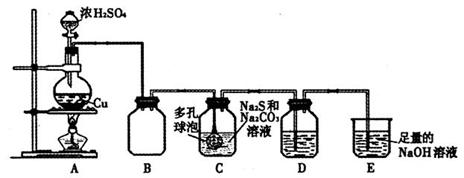
(1)装置A中滴加浓硫酸的仪器名称是 ,发生反应的化学方程式是 ,实验室还可以用A装置制取的气体单质有 (填化学式)。
(2)装置C中连接多孔球泡可以提高SO2的吸收效率,其依据的原理是 。
(3)装置D的作用是检验装置C中SO2的吸收效率,D中的试剂可以是 。
a.品红溶液 b.氢氧化钠溶液
c.酚酞溶液 d.酸性高锰酸钾溶液
(4)装置E的作用是 。
(5)实验制得的Na2S2O3·5H2O产品中可能含有Na2SO3、Na2SO4等杂质。请设计实验,检测Na2S2O3·5H2O产品中是否存在Na2SO4杂质,简要说明实验操作、现象和结论: 。
(6)Na2S2O3溶液是定量实验中的常用试剂,为了测定某K2Cr2O7溶液的浓度,研究小组的同学准确量取10.00mL K2Cr2O7溶液于锥形瓶中,加入过量KI固体和适量的稀H2SO4,滴加指示剂,用0.1000 mol·L-1 Na2S2O3标准溶液滴定至终点,3次平行实验测得平均消耗Na2S2O3溶液的体积为30.00 mL,则c(K2Cr2O7) = mol·L-1。(已知:Cr2O72— +6I— +14H+=2Cr3+ +3I2 +7H2O,2S2O32—+ I2=S4O62—+2 I—)
(9分)柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源。液体矿床以钾矿为主,伴生着镁、溴等多种矿产。某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
请根据以上流程,回答相关问题:
(1)操作①的名称是________;操作②名称是________。
(2)参照如图溶解度曲线,固体A是________(写化学式);固体B是________(写化学式);欲得到较纯的固体B需用少量的________(填“热水”或“冷水”)洗涤固体。
(3) 操作⑤是实验室常用的过滤方法——减压过滤(俗称抽滤或吸滤)。请问这种过滤方法其优点是_______________________。
(12分)50 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液在下图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
⑴大小烧杯间填或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)。其原因是。
⑶大烧杯上如不满碎泡沫塑料的作用。
⑵(填“能”盖硬纸板,对求得中和热数值的影响是(填“偏高”或“偏低”或“无影响”)。
⑷如果改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量(“增加”、“减少”或“不变”),所求中和热数值(“增加”、 “减少”或 “不变”)。
(13分)下图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为___________ (填代号)。能验证CO氧化产物的现象是___________________________________。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应________,活塞b应_________,需要加热的两处仪器装置有___________(填代号),m中反应的化学方程式为____________________________________。
(3)若气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,按A→G→E→D装置顺序制取干燥氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因有: __________________________________。
②实验中观察到E内有红棕色气体出现,证明氨气具有___________性。
测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数及物质的量分数。现有下列实验用品:中学化学实验常用仪器、1000 mL烧杯、100 mL量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19 g·cm-3)、水。按图示装置进行实验,回答下列问题。(设合金样品完全反应,产生的气体体积不超过100 mL)
(1).补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略):
①将称量后的合金样品用铜网小心包裹好,放在1000 mL烧杯底部,把短颈漏斗倒扣在样品上面。
②_________________________________________________________________________。
③_________________________________________________________________________。
④_________________________________________________________________________。
(2).合金样品用铜网包裹的目的是什么?
________________________________________________________________________。
(3).已知一定质量的铝锌合金的总物质的量为n,实验测得的气体体积为V1mL(已经换算为标准状况)。则铝锌合金中铝的物质的量分数为:_________________。(用含n和V1的式子表示)
(4)本装置也可用于测定金属锌(或其它金属)的相对原子质量,若m g金属锌进行实验,测得的气体体积为V2mL(已经换算为标准状况)。则金属锌的相对原子质量为:_________________。(用含m和V2的式子表示)
“碘钟”实验中,3I- + S2O82- = I3- + 2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
| c(I-)/mol·L- |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
| c(S2O82-)/mol·L- |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
| t /s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
(1)该实验的目的是。
(2)显色时间t2=.
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为(填字母)
A.<22.0s B.22.0~44.0s C.>44.0s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是。