松油醇是一种天然有机化合物,存在于芳樟油、玉树油及橙花油等天然植物精油中,具有紫丁香香气。松油醇结构如图所示,下列有关松油醇的叙述正确的是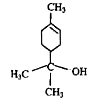
| A.松油醇的分子式为C10H20O |
| B.它属于芳香醇 |
| C.松油醇分子在核磁共振氢谱中有7个吸收峰 |
| D.松油醇能发生消去反应、还原反应、氧化反应、酯化反应 |
下列溶液中微粒的物质的量浓度关系错误的是 A.0. 1mol·L-1的NaHSO3溶液:c(H+)-c(OH-)=c(SO32-)-2c(H2SO3)
A.0. 1mol·L-1的NaHSO3溶液:c(H+)-c(OH-)=c(SO32-)-2c(H2SO3)
B .1 L0.1mol·L-1 (NH4)2Fe(SO4)2的溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-)
.1 L0.1mol·L-1 (NH4)2Fe(SO4)2的溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-)
C.浓度均为0. 1mol·L-1的NaHCO3和Na2CO3混合液:
c(Na+) >c(CO32-)>c(HCO3-) >c(OH-)>c(H+) D.向0.01mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:
D.向0.01mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
在密闭容器中,将1.0 mol CO与1.0 mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g)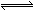 CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5 mol。则下列说法正确的是
CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5 mol。则下列说法正确的是
| A.800℃下,该反应的化学平衡常数为0.25 |
| B.427℃时该反应的平衡常数为9.4,则该反应的△H<0 |
| C.800℃下,若继续向该平衡体系中通入1.0 mol的CO(g),则平衡时CO物质的量分数为33.3% |
| D.800℃下,若继续向该平衡体系中通入1.0 mol的H2O(g),则平衡时CO转化率为66.7% |
下列离子方程式书写不正确的是
| A.碳酸氢铵和足量的氢氧化钠溶液反应:NH4++OH-=NH3↑+H2O |
| B.含等物质的量的硫酸氢钠与氢氧化钡两溶液混合: H+ + SO42-+Ba2+ +OH- = BaSO4 ↓+H2O |
| C.用稀硝酸浸泡做过银镜反应的试管:3Ag+4H++NO3-=3Ag++NO↑+2H2O |
D.用两个铜电极电解饱和食盐水:2Cl—+2H2O 2OH—+H2↑+Cl2↑ 2OH—+H2↑+Cl2↑ |
全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为:
V3++ VO2++H2O VO2++2H++V2+下列说法正确的是
VO2++2H++V2+下列说法正确的是
| A.放电时正极反应为:VO+2+2H++e—=VO2+ +H2O |
| B.放电时每转移2mol电子时,消耗1mol氧化剂 |
| C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极 |
| D.放电过程中,H+由正极移向负极 |
下列能用勒夏特列原理解释的是
①棕红色NO2加压后颜色先变深后变浅②FeCl3溶液加热后颜色加深
③Fe(SCN)3溶液中加入固体KSCN后颜色变深④氯水宜保存在低温、避光条件下⑤向H2S水溶液中加入NaOH有利于S2-增多⑥合成氨时将氨液化分离,可提高原料的利用率⑦向AgCl悬浊液中加入KI溶液有黄色沉淀生成
| A.①②⑤⑥ | B.②③④⑦. | C.①③⑤⑦ | D.全部 |