合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
一种工业合成氨的简式流程图如下:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:________________________________。
(2)步骤Ⅱ中制氢气的原理如下:
ⅰCH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
ⅱCO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
①对于反应ⅰ,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是___________。
a.升高温度 b.增大水蒸气浓度
c.加入催化剂 d.降低压强
②利用反应ⅱ,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
(3)图(a)表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程
示意图如下所示,完成下列填空: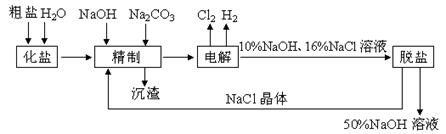
(1)在电解过程中,与电源正极相连的电极上电极反应为__________________________,与电源负极相连的电 极附近,溶液pH_________(选填“不变”、“升高”或“下降”)。
极附近,溶液pH_________(选填“不变”、“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为
____________________________________________________________。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是_________。
a. Ba(OH)2 b. Ba(NO3)2 c. BaCl2
(4)为了有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为_ ________(选填a、b、c)
________(选填a、b、c)
a. 先加NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂,再加Na2CO3
c. 先加Na2CO3,后加NaOH,再加钡试剂
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,
其负极反应为:
现有电解质溶液:①Na2CO3②NaHCO3③CH3COONa④ NaOH
(1)当四种溶液的pH相同时,其物质的量浓度由大到小的顺序是(填编号,以下相同)
(2)在上述四种电解质溶液中,分别加入AlCl3溶液,无气体产生的是
(1)纯水中c(H+)=5.0×10-7mol/L,则此时纯水中的c(OH-)=_______________;若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-)=_______________;在该温度时,往水中滴入NaOH溶液,溶液中的C(OH-)=5.0×10-2 mol/L,则溶液中c(H+)= 。
某课外兴趣小组在进行“诚信商品”实验时,随机抽取市售“碳酸氢钠”样品(成分说明见右表所示)。经检验杂质只含NaCl,准确称取8.5g样品,加入100mL盐酸恰好完全反应生成2.24L气体(标准状况)。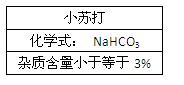
试回答下列问题:
(1)样品中NaHCO3的物质的量;
(2)样品中小苏打的质量分数;
(3)所用盐酸的物质的量浓度;
(4)根据计算结果及成分说明所提供信息,此产品(填“可以”或“不可以”)列入“诚信商品”。