下列溶液,按PH由小到大顺序排列的是
①0.1mol/L HCl溶液 ②0.1mol/L H2SO4溶液
③0.1mol/L NaOH溶液 ④0.1mol/L CH3COOH溶液
| A.①②④③ | B.②①④③ | C.②③④① | D.④③②① |
氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是。
(2)C、N、O三种元素第一电离能从大到小的顺序是。
(3)(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子轨道的杂化类型是。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(1)+2N2H4(l)=3N2(g)+4H2O(g)△H=" —103" 8.7kJ.mol—1
若该反应中有4mol N—H键断裂,则形成的 键有mol。
键有mol。
③肼能与硫酸反应生成N2H6SO4,N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在(填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
(4)氮化硼(BN)是一种重要的功能陶瓷材料,在与石墨结构相似的六方氮化硼晶钵中,层内B原子与N原子之间的化学键为___。
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为3.615×l0—10m,立方氮化硼晶胞中含有个氮原子、个硼原子,立方氮化硼的密度是g.cm一3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)
工业上生产氯气常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。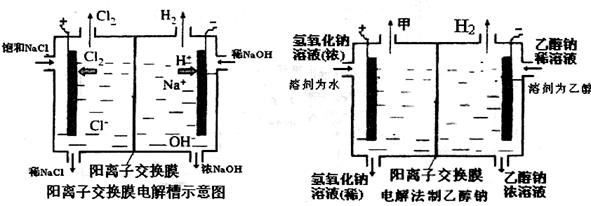
(1)这种阳离子交换膜,只允许溶液中的通过。(填下列微粒的编号)
①H2②Cl2③H+④Cl-⑤Na+⑥OH-
(2)写出在电解过程中发生的电极方程式阳极:。
(3)已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为。
(4)某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇。回答下列问题:
①写出在电解过程中发生的电极方程式
阴极:。
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是:。
合成氨对农业生产及国防建设均具有重要意义。
N2(g)+3H2(g)  2NH3(g)△H = -92 kJ·mol-1
2NH3(g)△H = -92 kJ·mol-1
(1)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(2)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:
① 表示N2的浓度变化的曲线是(选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2的浓度变化表示的化学反应平均速率是。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = (计算结果可用分数表示)。若升高温度,该反应的平衡常数值将_______(填“增大”、“减小”或“不变”)。
(3)在第25 min 末,保持其它条件不变,若升高反应温度并设法保持该温度不变,在第35 min末再次达到平衡。平衡移动过程中H2浓度变化了1.5 mol·L-1,请你在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(4)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol 。
①达平衡时,H2的转化率α1 = ____________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1 + α2 =1时,则起始时n (NH3)= ________mol。
(1)环境专家认为可以用金属铝将水体中的NO3-转化为N2,从而消除污染。该反应中涉及的微粒有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将这些微粒中除NO3-以外的微粒填入以下空格内(不用配平)。 
该反应过程中,被氧化与被还原的元素的物质的量之比为。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应是4Al +3O2+6H2O ="4" Al(OH)3。电池正极的电极反应式是;消耗13.5 g Al时转移_________mole-。
(3)铝与某些金属氧化物在高温下的反应称为铝热反应,可用于冶炼高熔点的金属。
已知:4Al(s) +3O2(g) = 2Al2O3(s)△H = -2830 kJ/mol △H = +230 kJ/mol
△H = +230 kJ/mol
C(s)+O2(g) = CO2(g)△H = -390 kJ/mol
铝与氧化铁发生铝热反应的热化学方程式是,铝热反应属于______(填字母)反应。
a.氧化还原 b.复分解 c.置换
烃A有如图的转化关系: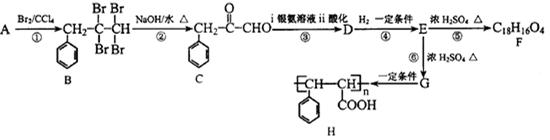
(1)物质C的分子式为____________.物质A的结构简式为_________________,
⑥的反应类型为__________,H中含氧官能团的名称为___________________.
(2)D的核磁共振氢谱图中会出现____________组吸收峰。
(3)写出E-F的化学反应方程式__________________。
(4)G的同分异构体中能同时满足如下条件:
①苯环上只有三个取代基,含有碳碳双键。
②能发生银镜反应,遇氯化铁溶液显紫色。
G共有____种同分异构体(不考虑立体异构),写出其中一种的结构简式____。