现有常温下的0.1 mol·l-1纯碱溶液。
(1)该溶液呈碱性是因为存在水解平衡,相关离子方程式是:________________。为证明存在上述平衡,进行如下实验:在0.1 mol·l-1纯碱溶液中滴加酚酞,溶液显红色,再往溶液中滴加 (填化学式)溶液,红色逐渐退为无色,说明上述观点成立。
(2)同学甲查阅资料得知常温下0.1 mol·L-1Na2CO3中,发生水解的CO32—不超过其总量的10%。请设计实验加以证明(写出实验方案及预期观察到的现象)。
答: 。
(3)同学乙就该溶液中粒子浓度关系写出五个关系式,其中不正确的是 。(双选,填序号)
| A.c(Na+)>2c(CO32—) |
| B.c(CO32—)>c(OH-)>c(HCO3—)>c(H2CO3) |
| C.c(OH-)=c(H+)+c(HCO3—)+2c(H2CO3) |
| D.c(CO32—)+c(HCO3—)="0.1" mol·L-1 |
E.c(H+)+ c(Na+)= c(OH-)+c(HCO3—)+c(CO32—)
(4)室温下,pH均为13的Na2CO3和NaOH溶液中,水电离产生的c(OH—)之比= 。
(5)25℃下,CuSO4溶液中的c(Cu2+)为0.020 mol/l,如果要生成沉淀,应调整溶液的pH大于 。
(25℃下,Cu(OH)2 的Ksp=2.0×10-20)
(1)按系统命名法命名.
有机物 的名称是。
的名称是。
(2)写出下列各种有机物的结构简式
①2,3-二甲基-4-乙基已烷
②支链只有一个乙基且式量最小的烷烃
烃A的分子式为C3H8,B、C是A的一氯代物,A~I有如下转化关系: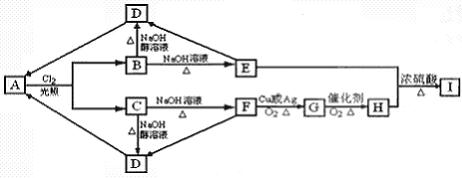
回答下列问题:
(1)C的结构简式_____________________。
(2)指出下列反应类型:
A→B:_____________________反应;E→D:______________________反应。
(3)写出下列转化的化学方程式:
B→D:_______________________________________________________________;
E+H→I:_____________________________________________________________。
(4)H有多种同分异构体。写出满足下列两个条件的一种同分异构体的结构简式:
________________________________(只写一种)。
①分子结构中有羟基:②与新制Cu(OH)2共热生成红色沉淀。
硅酸钠被国家列为“我国优先发展的精细化学品”和“今后我国无机化工产品发展重点”之一。下图是某种品位的石英砂矿石(主要成分是SiO2,还含有一定量的Fe2O3、Na2SO4、Na2CO3等杂质)制备硅酸钠的工艺流程示意简图:

阅读上述资料,回答下列问题
(1)作为“我国优先发展的精细化学品”,硅酸钠用途很多,请列举一个硅酸钠的用途
(2)石英矿粉用水淋洗,检验洗出液中含有SO42—的实验操作和实验现象分别是:用胶头滴管取2ml洗出液I于试管中,
(3)在操作I得到的滤渣中加入烧碱溶液,请写出反应的离子方程式
(4)“操作I”的名称为
“操作II”包含“蒸发浓缩、冷却结晶、过滤”系列操作,其中“蒸发浓缩”所用到的硅酸盐
材料的仪器有
(5)“取样分析”的目的是确保滤渣II中不含有杂质离子,简述“取样分析”的操作和实验现象:用胶头滴管取2ml洗出液II于试管中,
(6)下列关于Si、SiO2、Na2SiO3等物质的说法,不正确的是
| A.硅在周期表的位置是第三周期第IVA族 |
| B.原子半径大小关系:Na > Si > C > O |
| C.二氧化硅是酸性氧化物,能与强碱反应,不与任何酸反应 |
| D.实验室烧熔烧碱固体采用的仪器有酒精灯、玻璃棒、石英坩埚 |
E.Na2SO4、Na2CO3、Na2SiO3、SiO2均属于离子化合物
A、B、C、D四种元素在周期表中分别处于元素X的四周,已知X元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的。试确定:
| B |
||
| A |
X |
C |
| D |
(1)各元素的符号:
A C
(2)确定C、D、X最高价氧化物对应水化物的化学式,并排列酸性由强到弱的顺序 ____________。
(3)确定A、B、X气态氢化物的化学式,并排列稳定性由强到弱的顺序 _______。
用数字编号填空:在下述反应中,属于取代反应的是_____;属于氧化反应的是________;属于加成反应的是_________.
①由乙烯制氯乙烷②乙烷在空气中燃烧③乙烯使溴水褪色④乙烯使酸性高锰酸钾溶液褪色⑤乙烷在光照下与氯气反应