(1)某兴趣小组利用如图所示装置进行实验。
闭合K1,U形管内除电极上有气泡外,还可观察到的现象是 ;在A注射器收集到的气体是 ,阳极电极反应式为 。当电路中转移0.001mol电子时,B注射器最多可以收集到气体 mL(折算为标准状况)。
(2)某兴趣小组利用如图所示装置进行实验,对钢铁的电化学腐蚀原理进行探究。
①首先向锥形瓶内加入铁粉和碳粉的混合物、氯化钠溶液,半分钟后发现U型管内左侧液面高过右侧液面,这现象说明,在中性条件下发生 腐蚀,请写出该反应的电极反应方程式
负极: 正极:
②清洗锥形瓶后,重新加入铁粉和碳粉的混合物,加入1mol/L醋酸溶液,半分钟后发现U型管内左侧液面高过右侧液面,这一现象说明,前半分钟 腐蚀占优势,请写出这时正极主要的电极反应方程式 ,5分钟后发现U型管内右侧液面高过左侧液面,此时 腐蚀占据优势,请写出此时正极的电极反应方程式 。
在淀粉KI溶液中加入少量NaClO溶液,并加入少量硫酸,溶液立即变蓝,所发生的离子方程式是,
在上述蓝色溶液中滴加足量的Na2SO3溶液,现象是 ____________________,
所发生的离子方程式是。
(9分)现有A、B、C三种均含同一种元素的无机物,它们之间的转化关系如下图所示(部分产物已略去)。
(1)若A、D为非金属单质:
①当M(A)>M(D)时,D为:;
②当M(D)>M(A)时,A为: ;
;
(2)若A为非金属单质,D为金属单质时,A为:;
(3)若D为非金属单质,A、B、C为卤化物时,写出①的化学反应方程式:。
(10分)以黄铜矿(主要成份为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下: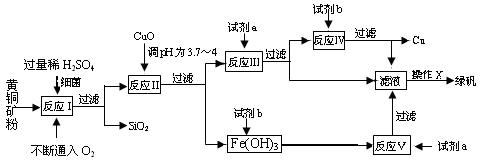

已知:①4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O;
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的p H如下表:
H如下表:
| 沉淀物 |
Cu(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀pH |
4.7 |
2.7 |
7.6 |
| 完全沉淀pH |
6.7 |
3.7 |
9.6 |
(1)试剂a是___________,试剂b是_____________。
(2)操作X应为蒸发浓缩、________________、________________。
(3)反应Ⅱ中加CuO调pH为3.7~4的目的是
。
(4)反应Ⅴ的离子方程式为___________________________。
为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理经处理后钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。主要反应如①②③:
① 3Fe+NaNO2+5NaOH = 3Na2FeO2+NH3+H2O
② ___Na2FeO2+____NaNO2+____H2O = N a2Fe2O4+NH3+NaOH
a2Fe2O4+NH3+NaOH
③ Na2FeO2+Na2Fe2O4+2H2O  Fe3O4+4NaOH
Fe3O4+4NaOH
(1)配平化学方程式②。
(2)上述反应②中还原剂为,被还原物质是 。若有1mol Na2Fe2O4生成,则反应中有____________mol电子转移。
。若有1mol Na2Fe2O4生成,则反应中有____________mol电子转移。
(3)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是:。
写出下列反应的离子方程式
(1)小苏打溶液与 烧碱溶液反应:______________________________________
烧碱溶液反应:______________________________________
(2)在稀氨水中通入过量CO2气体:____________________________________
(3)MnO2与浓盐酸共热制取氯气:_____________________________________